《化学能与电能》典例精析一
【例1】在理论上可用于设计原电池的化学反应是( )
A.2Al+2NaOH+2H2O=2NaAlO2+3H2↑
B.Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3·H2O+8H2O
C.CaC2+2H2O=Ca(OH)2+C2H2↑
D.CH4+2O2=CO2+2H2O
【解析】原电池中有电流产生,即有电子的流出或流入,而电子的流出或流入均是由于原电池的电极反应所产生的,故如果一个化学反应有电子的转移,也就是说,若一个化学反应属于氧化还原反应,则该反应就可以设计原电池,选项中A、D均为氧化还原反应。
【答案】AD
【例2】化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应式可以表示为:
![]()
已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法正确的是( )
①以上反应是可逆反应 ②以上反应不是可逆反应
③充电时化学能转变为电能 ④放电时化学能转变为电能
A.①③ B.②④ C.①④ D.②③
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明,一节废镍镉电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重。这是因为 。
【解析】(1)可逆反应是指相同条件下同时向正、逆两个方向进行的反应,原电池的充、放电不是在相同条件下进行的,所以不是可逆反应。
(2)物质以离子的形式存在,植物最容易吸收。从镍镉所对应的化合物的水溶性这一角度去分析,因在酸性土壤中Ni(OH)2和Cd(OH)2易溶解变成Ni2+和Cd2+,被植物吸收,造成污染。
【答案】(1)B (2)Ni(OH)2和Cd(OH)2能溶于酸性溶液
【例3】目前,市场上购买的笔记本电脑、移动电话、摄像机等低功耗电器所用的电池主要是( )
A.干电池 B.蓄电池 C.燃料电池 D.银锌电池
【解析】现阶段的笔记本电脑,移动电话等所使用的电池一般都是锂电池,锂电池是二次电池,故属于蓄电池。
【答案】B
【例4】将Al片和Cu片用导线相连,一组插入浓HNO3溶液中,一组插入稀NaOH溶液中,分别形成了原电池,则在两个原电池中,正极分别为( )
A.Al片、Cu片 B.Cu片、Al片
C.Al片、Al片 D.Cu片、Cu片
【解析】Al在浓HNO3中钝化,不反应,而Cu能与浓HNO3反应,故在浓HNO3介质中,Cu比Al活泼,Cu做负极,Al做正极;在NaOH溶液中,Al能与NaOH反应,而Cu则不能,故在NaOH介质中,Al比铜活泼,Al做负极,Cu做正极。
【答案】A
【例5】我国“神舟五号”载人宇宙飞船成功发射并收回,成为我国航天史上重要的里程碑。飞船上使用了氢氧燃料电池。其构造见下图,两极均有多孔性碳制成,通入的气体由孔隙中逸出并在电极表面放电。
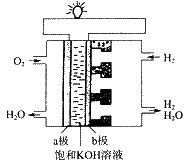
(1)a极是 极,b极是 极(填“正”或“负”),电极反应式为:a极 ;b极 。
(2)氢氧燃料电池的优点是燃料转化率高,无污染,若飞船中宇航员的生活用水均由燃料电池提供,将节省大量资金(1 kg水送入太空约耗资26万美元)。
已知:燃料电池发1度电,生成350 g水,其能量转化率为 。
提示:2H2(g)+O2(g)=2H2O(1) ΔH=-572 kJ/mo1
【解析】(1)由图可知,参加电极反应的是H2和O2,生成的是H2O,故在反应中H2失去电子被氧化,b为负极;O2得到电子被还原,a为正极。电极反应为:a极:2H2O+O2+4e-=4OH-;2H2+4OH--4e-=4H2O。
(2)1度电为1 kW·h,即3 600 kJ。 由2H2(g)+O2(g)=2H2O(1),ΔH=-572kJ/mol可知,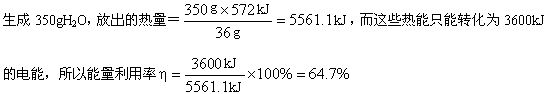
【答案】(1)正极 负极 a极:2H2O+O2+4e-=4OH-;b极:2H2+4OH--4e-=4H2O。
(2)64.7%
【例6】一种新型燃料电池,一极通入空气,另一极通入丁烷(C4H10)气体;电解质中掺杂氧化铱(Y2O3)、氧化锆(ZrO2)晶体,在熔融状态下传导O2—。下列对该燃料电池的说法正确的是( )
A.在熔融电解质中O2-由负极移向正极
B.电池的总反应式为:2C4H10+13O2→8CO2+10H2O
C.通入空气的一极是正极,电极反应式为O2+4e-=2O2-
D.通入丁烷的一极是正极,电极反应式为C4H10+26e-+13O2-=4CO2+5H2O
【解析】燃料电池中的化学反应,燃料(还原剂)在负极发生氧化反应,氧气(氧化剂)在正极发生还原反应,则通入丁烷的一极是负极,通入空气的一极是正极。电池电解质中离子的流向遵循电荷的异性相吸规律,负极呈阳性、阴离子流向阳极,正极呈阴性,阳离子移向正极。
【答案】BC
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
- 上一篇:《化学能与热能》典例精析二
- 下一篇:《化学能与电能》典例精析二
相关文章
-
没有相关内容


 会员登录
会员登录