《化学能与热能》典例精析二
1.下列物质的变化过程中,有共价键明显被破坏的是( )
A.I2升华
B.NaCl颗粒被粉碎
C.HCl溶于水得盐酸
D.从NH4HCO3中闻到了刺激性气味
【解析】化学反应的实质是旧键断裂和新键的形成,断键和生成新键都伴随能量的变化,而不管该过程是否发生了化学变化过程。因此本题不能错误理解成判断物理变化和化学变化。A中I2的升华是物理变化,共价键未被破坏。B中NaCl是离子化合物,其中只含离子键,无共价键。C中HCl是共价型分子,分子中有共价键。HCl溶于水形成盐酸的过程中发生变化:HCl=H++Cl-,此变化中H-Cl共价键被破坏。D中NH4HCO3是由NH4+和HCO3-构成的离子化合物,NH4+与HCO3-之间的化学键是离子键。NH4+内的原子之间,HCO3-内的有关原子之间的化学键是共价键。从NH4HCO3中闻到刺激性气味,是因为发生了化学反应:NH4HCO3=NH3↑+CO2↑+H2O。比较NH3和NH4+、CO2与HCO3-的组成可知,NH4HCO3分解的过程既有离子键被破坏,又有共价键被破坏。
【答案】C、D
2.下列说法不正确的是( )
A.在化学反应中,随着物质的变化,既有化学键的断裂,又有化学键的形成,还有化学能的改变
B.化学反应过程中是放出热量还是吸收热量,取决于反应物的总能量与生成物的总能量的相对大小
C.需要加热才能发生的化学反应,则该反应进行后一定是吸收热量的
D.物质具有的能量越低,其稳定性越大,反应越难以发生;物质具有的能量越高,其稳定性越小,反应越容易发生
【解析】需要加热才能发生的反应,反应后不一定是吸收能量的,如碳在空气中燃烧时需要加热才能进行,但反应后放出大量的热量。A、B、D都是正确的。
【答案】C
3.下列过程一定释放出能量的是( )
A.化合反应 B.分解反应 C.分子拆成原子 D.原子组成分子
【解析】化合反应不一定放热,如H2+I2=2HI就是吸热反应;分解反应多数是吸热反应,B也不对;由分子拆成原子是破坏化学键的过程,是吸热的,反过来则是放热的。
【答案】D
4.氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1 mol氢气中的化学键消耗的能量为Q1 kJ,破坏1 mol氯气中的化学键消耗的能量为Q2 kJ,形成1 mol氯化氢中的化学键释放的能量为Q3kJ。下列关系式中,正确的是( )
A.Q1+Q2>Q3 B.Q1+Q2>2Q3
C.Q1+Q2<Q3 D.Q1+Q2<2Q3
【解析】氢气在氯气中燃烧:![]() ,该反应放出热量,即反应中形成化学键所释放的能量大于断裂化学键所吸收的能量。在反应中,要破坏1 mol H-H键、1 mol Cl-Cl键,形成2 mol H-Cl键,所以2Q3-(Q1+Q2)>0,即Q1+Q2<2Q3。
,该反应放出热量,即反应中形成化学键所释放的能量大于断裂化学键所吸收的能量。在反应中,要破坏1 mol H-H键、1 mol Cl-Cl键,形成2 mol H-Cl键,所以2Q3-(Q1+Q2)>0,即Q1+Q2<2Q3。
【答案】D
5.下列变化中属于吸热反应的是( )
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释
④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰
A.①④ B.②③ C.①④⑤ D.②④
【解析】液态水汽化尽管吸收热量,但由液态水变为水蒸气是物理变化,不属于吸热反应。生石灰与水反应、浓H2SO4溶于水均放出热量。胆矾(CuSO4·5H2O)分解,KClO3分解均吸收热量,属于吸热反应。
【答案】D
6.在相同温度和压强下,将等质量的硫分别在足量的纯氧气、空气中燃烧,设前者放出的热量为Q1,后者放出的热量为Q2,则Q1和Q2的相对大小判断正确的是( )
A.Q1=Q2 B.Q1>Q2 C.Q1<Q2 D.无法判断
【解析】从硫在空气中燃烧比在纯氧气中燃烧的火焰的明亮度差,剧烈程度低可知,硫在纯氧气中燃烧更快,发光更强。等质量的硫燃烧放出的能量(在相同条件下)是一定的,而发光、发热均是能量转化的体现形式,根据总能量一定,发光越多,转化为热能的部分就越少,所以等质量的硫在空气中燃烧放出的热量要比在纯氧气中燃烧放出的热量多。
【答案】C
7.已知反应X+Y=M+N为放热反应,对该反应的说法正确的是( )
A.X的能量一定高于M
B.Y的能量一定高于N
C.X和Y的总能量一定高于M和N的总能量
D.因为该反应为放热反应,故不必加热就可发生
【解析】从物质储存的能量来分析,各种物质都储存有化学能,不同的物质所包含的化学能各不相同。一个确定的化学反应的热效应,决定于反应物的总能量与生成物的总能量的相对大小。
在化学反应中,“能量的变化”与反应发生的“需要条件”没有必然的联系。有些放热反应在常温下就可以进行,如白磷的缓慢氧化、自燃和酸碱中和反应等。有些放热反应却需要较高温度才能发生,如铁丝在氧气中燃烧、铁粉和硫粉的反应等。
【答案】C
8.将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是( )
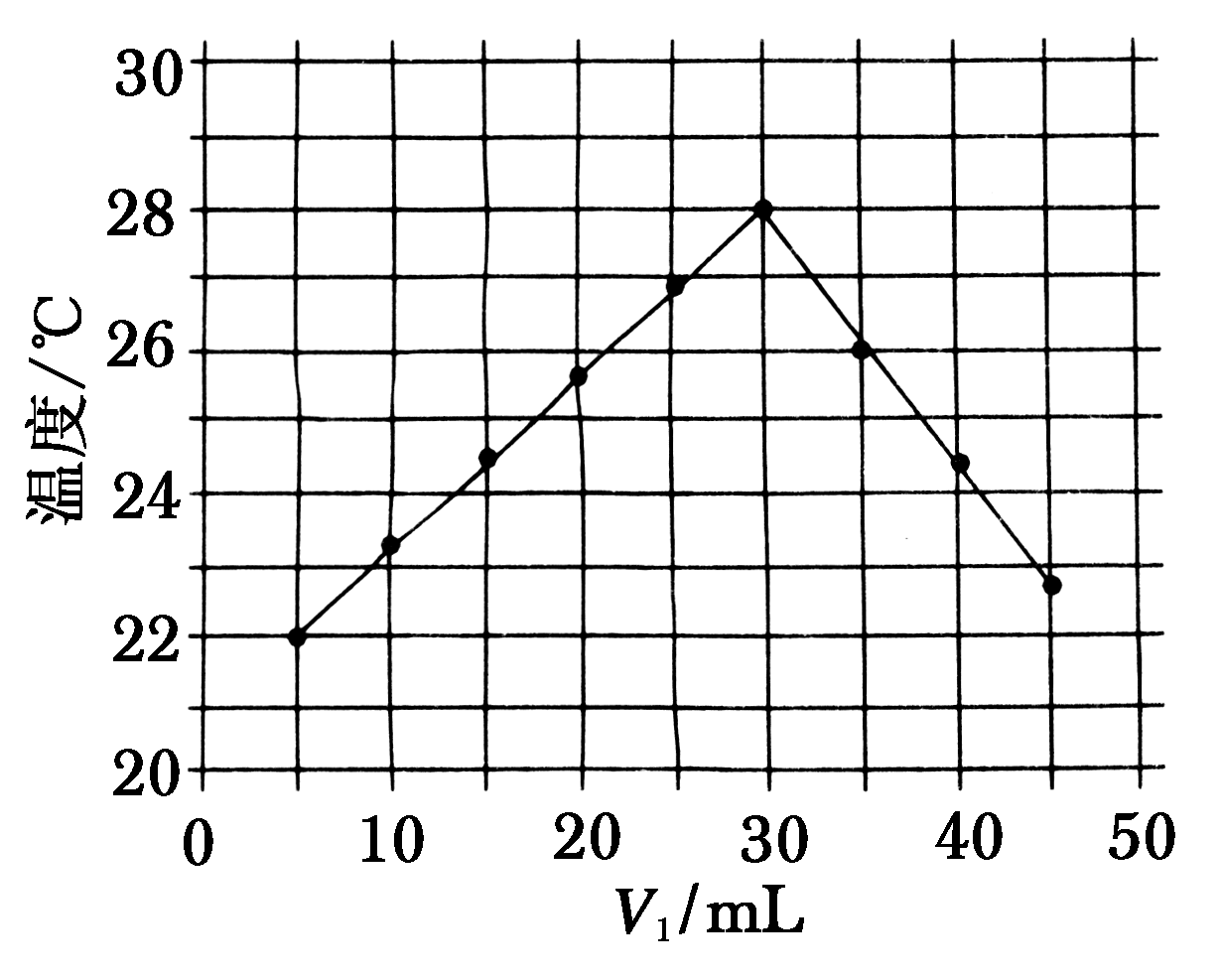
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.0 mol/L
D.该实验表明有水生成的反应都是放热反应
【解析】图中22 ℃是盐酸体积为5 mL时的溶液温度,并非是环境温度,由滴加30 mL盐酸溶液温度最高知,此时盐酸与NaOH溶液恰好反应,则NaOH溶液体积为20 mL,因而NaOH溶液浓度不是1.0 mol/L。
【答案】B
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
- 上一篇:《化学能与热能》典例精析一
- 下一篇:《化学能与电能》典例精析一
相关文章
-
没有相关内容


 会员登录
会员登录