《化学能与电能》典例精析二
1.如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池。下列叙述正确的是( )
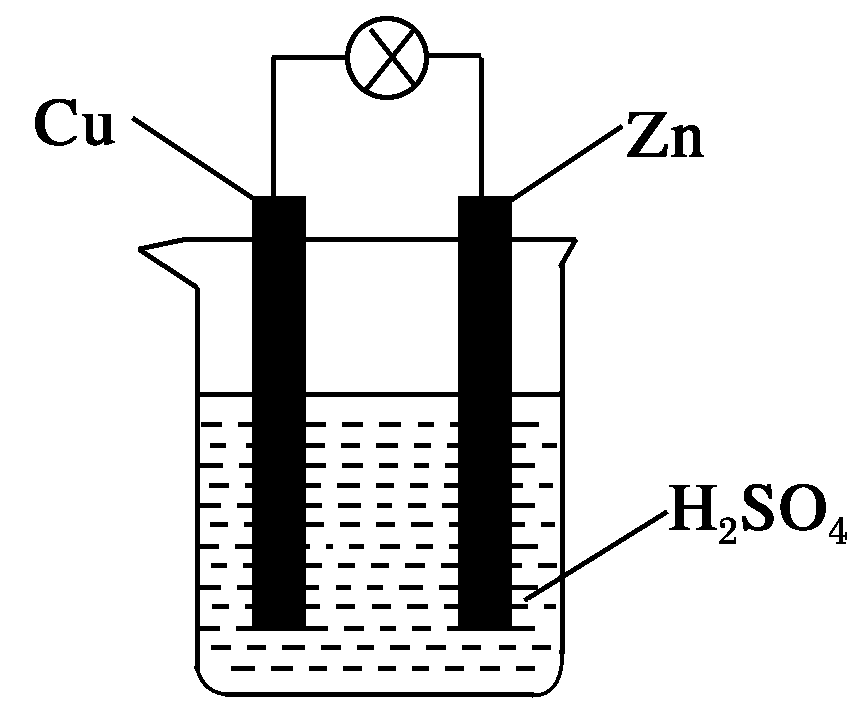
A.Zn是负极,发生还原反应
B.电流从锌片流向铜片
C.一段时间后,铜片质量减轻
D.该装置将化学能转变为电能
【解析】A中Zn发生氧化反应,B中电流的方向从正极→负极,C中一段时间后,锌片质量减轻,故只有D正确。
【答案】D
2.关于下图所示的原电池,下列说法正确的是( )
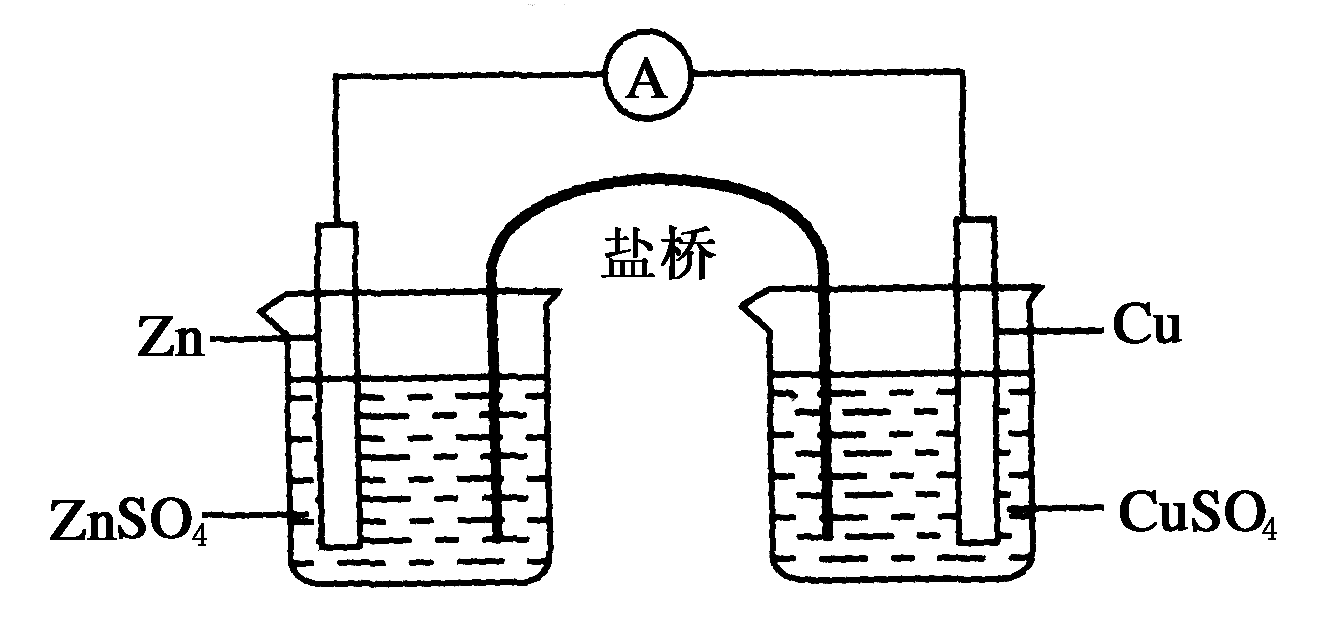
A.电子从锌电极通过检流计流向铜电极
B.盐桥中的阴离子向硫酸铜溶液中迁移
C.锌电极发生还原反应,铜电极发生氧化反应
D.铜电极上发生的电极反应是:2H++2e-=H2↑
【解析】图示原电池中,Zn为负极发生氧化反应,Cu为正极发生还原反应,故A项正确,C项错;原电池工作时,ZnSO4溶液中的Zn 2+浓度增大,所以盐桥中的阴离子向ZnSO4溶液中迁移,B项错;铜电极上发生的反应是Cu2++2e-―→Cu,D项错。
【答案】A
3.如图所示,烧杯中盛的是水,铁圈和银圈直接相连,在接头处用一根绝缘细丝吊住,并使之平衡,小心地从烧杯中央滴入CuSO4溶液,反应一段时间后,观察到的现象是( )
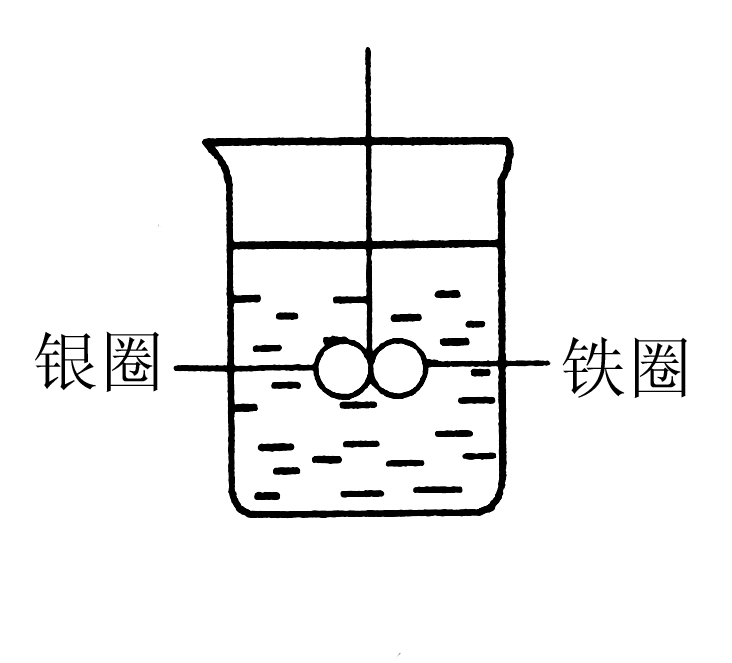
A.两圈仍保持平衡 B.有气泡产生,两圈摇摆不定
C.铁圈向下倾斜 D.银圈向下倾斜
【解析】上述铁圈、银圈和硫酸铜溶液构成了原电池(铁圈和银圈活泼性不同且相互接触从而构成闭合回路)。其电极反应式为:负极Fe-2e-=Fe2+,铁溶解,铁圈减轻;正极Cu2++2e-=Cu,生成的Cu沉积在银圈上,银圈增重。
【答案】D
4.根据下列实验事实:(1)X+Y2+=X2++Y;(2)![]() ;(3)Z2+的氧化性比X2+弱;(4)由Y、W电极组成原电池,电极反应为W2++2e-=W,Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序是( )
;(3)Z2+的氧化性比X2+弱;(4)由Y、W电极组成原电池,电极反应为W2++2e-=W,Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序是( )
A.X>Z>Y>W B.Z>W>X>Y
C.Z>X>Y>W D.Z>Y>X>W
【解析】(1)中X能置换出Y,说明还原性X>Y;(2)中Z可与冷水反应,说明Z是极活泼金属;(3)说明还原性Z>X;(4)中Y、W形成原电池时,Y作负极,说明还原性Y>W。综上所述,几种金属的还原性由强到弱的顺序为Z>X>Y>W。
【答案】C
5.下列叙述正确的是( )
A.纯锌与稀硫酸反应时,加入少量CuSO4溶液,可使反应速率加快
B.甲醇和氧气以及KOH溶液构成的新型燃烧电池中,其负极上发生的反应为:CH3OH+6OH-+6e-=CO2+5H2O
C.在铁件上镀铜时,金属铜作阴极
D.电解精炼铜时,电解质溶液中铜离子浓度保持不变
【解析】锌置换出少量铜后形成锌原电池,使反应速度加快,A项正确;负极上应发生失去电子的氧化反应,并且CO2在碱性环境中要生成CO32-,B项错;电镀池中,镀层金属作阳极,C项错;电解精炼铜时,溶液中铜离子浓度降低,D项错。
【答案】A
6.汽车的启动电源常用铅蓄电池,放电时的电池反应如下:PbO2+Pb+2H2SO4=2PbSO4↓+2H2O,根据此反应判断下列叙述中正确的是( )
A.PbO2是电池的负极
B.负极的电极反应式为:Pb+SO42--2e-=PbSO4↓
C.PbO2得电子,被氧化
D.电池放电时,溶液酸性增强
【解析】根据电极反应知铅失电子被氧化,铅作负极,PbO2被还原作正极。放电过程中消耗了硫酸,溶液的酸性减弱。
【答案】B
7.一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是( )
A.CH3OH(g)+O2(g)-2e-=H2O(l)+CO2(g)+2H+(aq)
B.O2(g)+4H+(aq)+4e-=2H2O(l)
C.CH3OH(g)+H2O(l)-6e-=CO2(g)+6H+(aq)
D.O2(g)+2H2O(l)+4e-=4OH-(aq)
【解析】甲醇燃料电池是甲醇在负极发生氧化反应,氧气在正极发生还原反应,故B、D错误;A项不是电极反应式。
【答案】C
8.将铁棒和锌棒用导线连接插入CuSO4溶液里。当电池中有0.2 mol电子通过时,负极质量的变化是( )
A.增加5.6 g B.减少0.1 g C.减少6.5 g D.增加6.4 g
【解析】在原电池中,负极失去电子发生氧化反应,正极得到电子发生还原反应,并且电极失去电子总数等于正极得到电子总数。不能正确判断负极反应及用电子守恒解决问题是本题易出现的错误。
负极反应式:Zn-2e-=Zn2+
故负极质量减少![]() 。
。
【答案】C
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
- 上一篇:《化学能与电能》典例精析一
- 下一篇:化学能与热能的相互转化
相关文章
-
没有相关内容


 会员登录
会员登录