从三个方面充分认识Na2O2的性质
1.从元素化合价角度分析Na2O2的性质
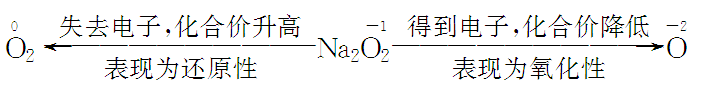
2.强氧化性的五个表现
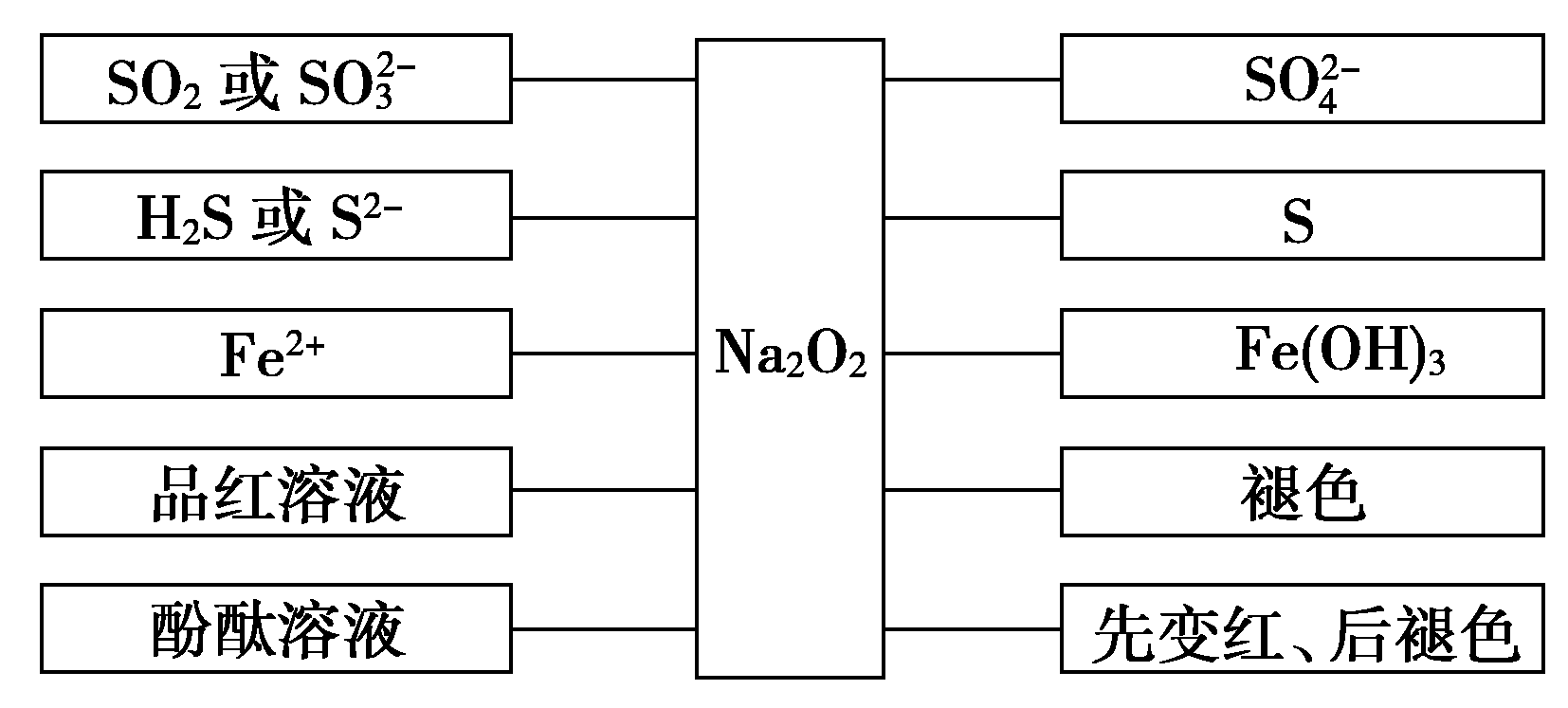
3.在分析Na2O2与其他溶液的反应时,一定不能忽略其溶液的强碱性。
对点专练
1.将Na2O2分别投入到含有下列离子的溶液中,按要求回答问题:
①S2- ②SO32- ③HCO3- ④Fe2+ ⑤CO32-
⑥SO42- ⑦CH3COO- ⑧NH4+
(1)离子浓度明显减小的是________。
(2)离子浓度明显增大的是________。
(3)离子浓度基本不变的是________。
答案:(1)①②③④⑧ (2)⑤⑦ (3)⑥
2.比较下列四组反应,回答下列问题:
一组:①Na2O2+CO2 ②Na2O2+SO2
二组:③Na2O2+FeCl3(溶液) ④Na2O2+FeCl2(溶液)
三组:⑤SO2通入品红溶液中,加热 ⑥Na2O2加入品红溶液中,加热
四组:⑦NaOH溶液滴入紫色石蕊试液中 ⑧Na2O2固体加入紫色石蕊试液中
问题:(1)写出①、②两反应的化学方程式。
(2)判断③、④反应中可能发生的现象,为什么?
(3)判断⑤、⑥反应中可能发生的现象,为什么?
(4)判断⑦、⑧反应中可能发生的现象,为什么?
答案:(1)①2Na2O2+2CO2===2Na2CO3+O2
②Na2O2+SO2===Na2SO4
(2)现象:③有红褐色沉淀生成,④生成灰绿色沉淀,最后变为红褐色,二者均有气泡放出,④中气体明显少于③中气体。原因:③中Na2O2与溶液中的水剧烈反应会有NaOH和O2产生,FeCl3与NaOH反应生成Fe(OH)3,Fe(OH)3是不溶性的红褐色沉淀;④中Fe2+具有强还原性,易被Na2O2氧化并生成Fe(OH)3,但中间产物为Fe(OH)2和Fe(OH)3的混合物为灰绿色。
(3)现象:⑤溶液红色褪去,加热后又恢复红色;⑥溶液红色褪去,加热后不能恢复红色。原因:SO2的漂白性不稳定,具有可逆性,Na2O2的漂白性是因其具有强氧化性,不可逆。
(4)现象:⑦溶液变蓝;⑧溶液先变蓝后褪色。原因:Na2O2与H2O反应生成NaOH,呈碱性,同时Na2O2又有漂白性。
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
相关文章
-
没有相关内容


 会员登录
会员登录