冰醋酸溶于水后溶液导电性变化分析实验
一、问题的提出
在稀释弱电解质浓溶液时,一般为什么开始时溶液的导电性逐渐增强,以后又逐渐减弱?为了帮助同学们正确理解和回答这个问题,我们设计了下述实验。 本文来自中学化学同步辅导!
二、实验步骤及数据 本文来自中学化学同步辅导!
1、试剂:冰醋酸(CH3COOH含量≥99.0%,密度1.05g/mL)、蒸馏水。
2、仪器:电流计、直流稳压电源、100mL烧杯、石墨电极。
3、装置图及实验步骤 本文来自中学化学同步辅导!
①按下图装置先测出电流通过冰醋酸、蒸馏水时的电流强度。
②再用同样的方法测出电流通过不同浓度的醋酸溶液时的电流强度。
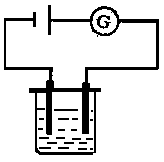

(注意:整个实验过程中,实验操作条件保持不变。石墨电极要求清洁、干燥。)
4、实验数据记录
电流通过冰醋酸(浓度为17.33mol/L)和蒸馏水时的电流强度分别为15μA和86μA,电流通过其他浓度的醋酸溶液时的电流强度如上表。
5、绘制醋酸浓度和电流强度的曲线图,以醋酸浓度C为横座标,以电流计读数I,用mA表示)为纵座标,作出I—C曲线图。

三、结论和解释 本文来自中学化学同步辅导!
1、冰醋酸的导电性比蒸馏水的还弱得多(它几乎不导电),这是因为冰醋酸(本实验是在20℃时做的,此时冰醋酸系液态)含水极少,它几乎不发生电离之故。 本文来自中学化学同步辅导!
2、加水稀释冰醋酸,直至浓度为2mol/L左右时,在这个浓度范围内(17.33至2mol/L),随着溶液的稀释,醋酸的电离度逐渐增大,自由移动离子的浓度也增大(溶液体积虽然增大,但它处于矛盾的次要方面),所以溶液的导电性逐渐增强。
3、当浓度在2mol/L以下再加水稀释时,虽然醋酸的电离度仍在逐渐增大,但这一过程中溶液体积的增大已成为矛盾的主要方面,致使溶液自由移动离子的浓度逐渐减小,因此溶液的导电性逐渐减弱。
4、对于其他易溶于水的弱电解质溶液的导电性与溶液浓度的关系也能得出相似的结论(如氨水等)。
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
- 上一篇:《弱电解质的电离课堂实录》pdf
- 下一篇:关于弱电解质几个容易混淆的问题
相关文章
-
没有相关内容


 会员登录
会员登录