《化学反应的速率和限度》典例精析一
【例1】在一定条件下,当单独改变可逆反应![]() (正反应放热)的下列条件后,有关的叙述正确的是( )
(正反应放热)的下列条件后,有关的叙述正确的是( )
A.加入催化剂,v(正)、v(逆)都发生变化,且变化倍数相等
B.增大N2的浓度,v(正)增大,v(逆)减小
C.降低温度,v(正)、v(逆)都减小,且v(正)减小的倍数大于v(逆)减小的倍数
D.减小NH3的浓度,v(正)不变,v(逆)减小
【解析】![]() (正反应放热)加催化剂能同等倍数地改变正、逆反应速率,A正确;增大N2的浓度,则v(正)增大(突变),v(逆)也增大(渐变),B错误;降低温度,v(正)、v(逆)都减小,因为正反应放热,故v(正)减小的倍数小于v(逆)减小的倍数,C错误;减小NH3的浓度,v(正)减小(渐变),v(逆)也减小(突变),故D错误。
(正反应放热)加催化剂能同等倍数地改变正、逆反应速率,A正确;增大N2的浓度,则v(正)增大(突变),v(逆)也增大(渐变),B错误;降低温度,v(正)、v(逆)都减小,因为正反应放热,故v(正)减小的倍数小于v(逆)减小的倍数,C错误;减小NH3的浓度,v(正)减小(渐变),v(逆)也减小(突变),故D错误。
【答案】A
【例2】对于可逆反应![]() ,在t1时刻增大压强,其速率与时间图像如下:
,在t1时刻增大压强,其速率与时间图像如下:
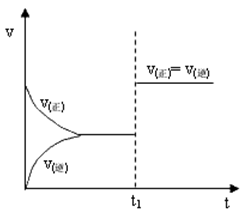
则下列关系正确的是( )
A.a+b>c+d B.a+b<c+d C.a+b=c+d D.无法判断
【解析】t1时刻增大压强,v(正)=v(逆),说明化学平衡不移动,则a+b=c+d。
【答案】C
【例3】化学反应![]() 的正反应是放热反应,在一定的条件下达到了化学平衡。要再提高化学反应速率并使化学平衡向逆反应方向移动,下列措施中最合适的是( )
的正反应是放热反应,在一定的条件下达到了化学平衡。要再提高化学反应速率并使化学平衡向逆反应方向移动,下列措施中最合适的是( )
A.施加负催化剂并加压 B.施加正催化剂并加压
C.施加正催化剂并加热 D.加热并加压
【解析】催化剂只能改变化学反应速率,不能改变化学平衡,正催化剂能提高化学反应速率,负催化剂能降低化学反应速率。![]() 的正反应,既是放热反应又是气体总体积缩小的反应,加热能提高化学反应速率并使化学平衡向逆反应方向移动;加压能提高化学反应速率并使化学平衡向正反应方向移动。
的正反应,既是放热反应又是气体总体积缩小的反应,加热能提高化学反应速率并使化学平衡向逆反应方向移动;加压能提高化学反应速率并使化学平衡向正反应方向移动。
【答案】C
【例4】应用已知化学反应条件的知识解释下列实际问题。
(1)将溶液里的A1Cl3转化为Al(OH)3沉淀,沉淀剂用氨水比用氢氧化钠溶液好,主要理由是 ;
(2)实验室用石灰石和酸制取二氧化碳气体,酸用稀盐酸比用稀硫酸好,主要理由是 ;
(3)实验室用稀硫酸和锌制取氢气,用废旧干电池的外壳比用纯锌好,主要理由是 ;
(4)除去玻璃热水瓶内壁上的水垢,用醋酸比用碳酸(二氧化碳)好,主要理由是 ;
(5)家庭燃烧煤气或天然气做饭,用空气比用纯氧气好,主要理由是 ;
(6)![]() 是工业制备硫酸中的关键化学反应,假设能使其变为不可逆反应会更好,主要理由是 。
是工业制备硫酸中的关键化学反应,假设能使其变为不可逆反应会更好,主要理由是 。
【答案】(1)Al(OH)3易溶于氢氧化钠溶液不溶于氨水,用氨水比用氢氧化钠溶液好控制沉淀剂的用量;(2)氯化钙易溶于水,硫酸钙微溶于水,硫酸钙包裹在石灰石的表面阻碍着石灰石跟酸的反应;(3)纯锌比废旧干电池的外壳成本高;废旧干电池的外壳中有锌和炭,在稀硫酸中发生原电池反应,反应速率快;(4)碳酸的酸性太弱,化学反应很慢,除垢需要的时间太长;(5)空气中的氧气足以使煤气或天然气发生快速、较充分的燃烧,而纯氧气价格贵,做饭成本高;(6)不可逆反应比可逆反应进行的限度高,能提高原料向产品转化的百分率,提高生产的经济效益。
【例5】下列试剂保存的方法中,不正确的是( )
A.过氧化钠应密封保存在塑料瓶中
B.保存液溴时要在溴的上面加少量水
C.氯水应用无色透明的试剂瓶盛装
D.硝酸银要用棕色瓶盛装并放在黑暗处
【解析】过氧化钠易和空气中的H2O,CO2反应,生成NaOH,Na2CO3,所以应密封保存在塑料瓶中,A是正确的;液溴易挥发,在液溴中加少量的水保存,防止挥发,B正确;硝酸银见光易分解,用棕色瓶盛装放在黑暗处,D是正确的;氯水中存在如下反应:![]() 所以氯水应避光保存,放在棕色瓶中及黑暗处,C错误。
所以氯水应避光保存,放在棕色瓶中及黑暗处,C错误。
【答案】C
【例6】将a g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,将b g(a>b)粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是( )

【解析】在化学反应CaCO3+2HCl=CaCl2+CO2↑+H2O中。盐酸是足量的。CaCO3完全反应。CaCO3又分为质量不同和粒度不同两种情况。块状CaCO3质量大,放出的CO2多但慢;粉末状CaCO3质量小,放出的CO2少但快。
【答案】C
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
相关文章
-
没有相关内容


 会员登录
会员登录