《化学键》典例精析一
【例1】关于化学键的下列叙述中,不正确的是( )
A.离子化合物中可能有共价键 B.共价化合物中可能含有离子键
C.离子化合物中一定有离子键 D.共价化合物中不含离子键
【解析】只要有离子键,就一定是离子化合物,离子化合物中也一定含有离子键,在离子化合物中还可能有共价键,如NaOH、NH4Cl等;而共价化合物中一定不存在离子键。
【答案】B
【例2】下列分子含有的电子数目与HF相同,且只有两个极性共价键的是( )
A.CO2 B.N2O C.H2O D.CH4
【解析】HF分子里有10个电子,CO2分子和N2O分子各有22个电子,H2O分子和CH4分子各有10个电子。H2O分子有两个极性共价键,CH4分子有四个极性共价键。
【答案】C
【例3】下列数值表示有关元素的原子序数,各原子能以离子键相互结合成稳定的化合物的是( )
A.10与19 B.6与16 C.11与17 D.14与8
【解析】根据元素原子序数判断原子之间是否能形成离子键或共价键,一般分两步完成。第一步是判断元素中是否有活泼的金属元素和活泼的非金属元素,判断元素性质的根据是元素的“位—构—性”关系;第二步是确定元素的原子之间是形成离子键还是形成共价键,判断元素原子之间是形成离子键还是共价键的根据是:活泼的金属元素与活泼的非金属元素相互化合时一般形成离子键;其他元素相互化合时一般形成共价键。11号元素是Na,属于活泼的金属元素;17号元素是Cl,属于活泼的非金属元素,二者化合时形成离子键。
【答案】C
【例4】下列电子式书写正确的是( )
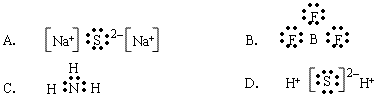
【解析】Na2S电子式应为:![]() ,A项错;NH3电子式应为:
,A项错;NH3电子式应为: ,C项漏写了1对孤对电子,错;H2S是共价化合物,电子式应为:
,C项漏写了1对孤对电子,错;H2S是共价化合物,电子式应为:![]() ,D项错。
,D项错。
【答案】B
【例5】A、B、C、D、E代表5种微粒,每种微粒都含有18个电子。其中A和C都是由单原子形成的阴离子;B、D和E都是分子;又知在水溶液中A跟B反应可生成C和D;E具有强氧化性。请回答:
(1)用化学符号来表示上述5种微粒:A 、B 、C 、D 、E 。
(2)在水溶液中A跟B反应的离子方程式是 。
【解析】由单原子形成的含18个电子的阴离子(A和C)有P3-、S2-、Cl-,含18个电子的分子(B、D和E)有F2、PH3、H2S、HCl、CH3F、CH3CH3、CH3OH、CH3NH2、H2O2。在所列举的微粒中,符合A+B→C+D的是S2-(A)+HCl(B)=Cl-(C)+H2S(D),具有强氧化性的是F2(E)。
【答案】(1)S2- HCl Cl- H2S F2
(2)S2-+2H+=H2S↑
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
- 上一篇:《化学键》本节课本插图4幅
- 下一篇:《化学键》典例精析二
相关文章
-
没有相关内容


 会员登录
会员登录