《元素周期律》典例精析二
1.X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有1个电子,则X和Y形成的化合物的化学式可表示为( )
A.XY B.XY2 C.XY3 D.X2Y3
【解析】短周期中,最外层电子数是次外层电子数一半的元素有Li和Si,若X是Li,则它的前一周期中最外层只有1个电子的是H,两者能组成化合物LiH;若X是Si,则它的前一周期最外层只有1个电子是Li,Li和Si不能形成选项所示的化合物。
【答案】A
2.下面是四种粒子的结构示意图,据此完成以下填空:

(1)属于阳离子结构的粒子是 。(填字母序号)
(2)B粒子的半径 C粒子的半径。(填“大于”“小于”或“等于”)
(3)某元素R形成的氧化物为R2O3,则R的原子结构示意图可能是 。(填字母序号)
【解析】A中质子数-电子数=-2,为阴离子;B中质子数-电子数=2,为阳离子;C、D为原子。B、C为同一元素的阳离子和原子,其中B少一个电子层,原子半径B<C。在R2O3中,R显+3价,即R原子与O原子结合时失去3个电子,故R可能是D。
【答案】(1)B(2)小于(3)D
3.应用元素周期律分析下列推断,其中正确的组合是( )
①碱金属单质的熔点随原子序数的增大而降低
②砹(At)是第ⅦA族,其氢化物的稳定性大于HCl
③硒(Se)的最高价氧化物对应水化物的酸性比硫酸弱
④第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
⑤铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
⑥第三周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱
A.①③④ B.①③⑥ C.③④⑤ D.②④⑥
【解析】第ⅦA族元素从上到下非金属性递减,氢化物稳定性逐渐减弱,②错;第二周期中氮元素的氢化物NH3溶于水后,水溶液呈碱性,④错;第ⅢA族元素从上到下金属性增强,铊只与盐酸反应,⑤错。
【答案】B
4.下列有关叙述正确的是( )
A.元素的化学性质随着相对原子质量的递增而呈周期性变化
B.元素周期律的实质是因为元素原子最外层电子数由1→8周期性变化而引起的
C.半径由大到小、氧化性由弱到强的是:K+、Mg2+、Al3+、H+,而还原性由弱到强的则是:I-、Br-、Cl-、F-
D.某元素R的最高价氧化物化学式为:R2O5,又知R的气态氢化物中含氢的质量分数为8.8%,则R的相对原子质量为28
【解析】按相对原子质量,Te 127.6,而I 126.9,两元素都有五个电子层,但Te最外层电子数是6个,而且I是7个。如果按相对原子质量大小顺序排列,I与Te应该互换位置,而这又造成了元素性周期性变化的改变。因此,按元素的相对原子质量大小顺序排列不是元素性质呈周期性变化的依据。因此A项不正确。B项正确。C项从离子结构分析:
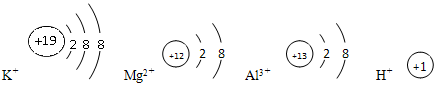
故离子半径大小顺序为r(K+)>r(Mg2+)>r(Al3+)>r(H+)。对比它们的氧化性,根据学过的金属活动性顺序表,它们原子的还原性由钾到氢逐渐减弱,反过来它们离子的氧化性逐渐增强。命题信息是正确的,但题中后半部,I-、Br-、Cl-、F-半径是逐渐减小。I-、Br-、Cl-、F-还原性应由强到弱。而题中却说:“还原性由弱到强的则是I-、Br-、Cl-、F-”是错误的。故C项不正确。D项某元素最高价氧化物化学式为R2O5,则R为+5价,负价应为-3价,其形成气态氢化物为RH3。根据已知,![]() ,M(R)=31,排除D项。
,M(R)=31,排除D项。
【答案】B
5.X、Y、Z和R分别代表四种元素。若aXm+、bYn+、cZn-、dRm-四种离子的核外电子排布相同,且m>n,则下列关系正确的是( )
A.a-c=m-n B.b-d=m+n
C.a>b>d>c D.a>b>c>d
【答案】B、D
【解析】“核外电子排布相同”说明四种离子之间存在关系a-m=b-n=c+n=d+m,B项正确,A不正确。“核外电子排布相同”说明四种离子的核电荷数中a、b均大于c、d;又“m>n”,说明aXm+与bYn+中a>b,cZn-与dRm-中c>d。
6.元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是( )
A.同周期元素中X的金属性最强
B.原子半径X>Y,离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强
【解析】由“元素X、Y、Z原子序数之和为36,X+与Z2-具有相同的核外电子层结构”,知X元素为Na元素,Z元素为O元素,故Y元素原子序数为36-11-8=17,故Y元素为Cl元素。离子半径:X+<Z2-,因此B项错误。
【答案】B
7.下列排列顺序正确的是( )
A.热稳定性:H2O>H2S>SiH4
B.原子半径:Na>N>Al
C.酸性:H3PO4>H2SO4>HClO4
D.碱性:NaOH>Be(OH)2>Mg(OH)2
【解析】据同周期递变性知,非金属性:S>Si、Cl>S>P,原子半径:Na>Al>P,金属性:Na>Mg;依据同主族的递变性知,非金属性:O>S,原子半径:P>N,金属性:Mg>Be;故氢化物的热稳定性:H2O>H2S>SiH4,原子半径:Na>Al>N,酸性:HClO4>H2SO4>H3PO4,碱性:NaOH>Mg(OH)2>Be(OH)2。所以A项正确。
【答案】A
8.a、b、c、d、e是同周期的五种元素,a和b的最高价氧化物对应水化物呈碱性,且碱性b>a;c和d的气态氢化物的还原性d>c;五种元素的原子,得失电子后所形成的简单离子中e的离子半径最小,则它们的原子序数由小到大的顺序是( )
A.b、a、d、c、e B.e、b、a、d、c
C.b、a、e、d、c D.c、d、e、a、b
【答案】C
【点拨】同周期元素,从左至右,最高价氧化物水化物的碱性依次减弱,气态氢化物还原性依次增强,由此知,原子序数a>b,c>d,且c>d>a>b在元素原子得失电子的形成的简单离子中原子序数最大的金属元素离子半径最小,因此它们的原子序数关系为c>d>e>a>b,选C。
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
- 上一篇:《元素周期律》典例精析一
- 下一篇:元素金属性、非金属性强弱比较
相关文章
-
没有相关内容


 会员登录
会员登录