《溶液的浓度》典例精析一
第一课时
【例题1】一种抗生素为粉末状固体,每瓶含0.5 g,注射时应配成质量分数为20%的溶液,则使用时每瓶至少需加入蒸馏水( )
A.1.5 mL B.2 mL C.3 mL D.4 mL
【难度】中
【精析】解:设至少需加入蒸馏水的质量为x
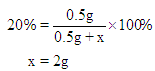
需要水的体积 =2mL
【答案】B
【例题2】向100 g10%的NaCl溶液中加入12.5 gNaCl固体,完全溶解后,所得溶液中溶质质量分数为( )
A.12.5% B.20% C.22.5% D.25%
【难度】中
【精析】所得溶液中溶质质量分数为:
![]()
【答案】B
【例题3】保持温度不变,小心蒸发NaCl不饱和溶液(蒸发皿中始终有溶液),则溶液中溶质的质量分数(m%)与时间(t)的关系合理的是( )
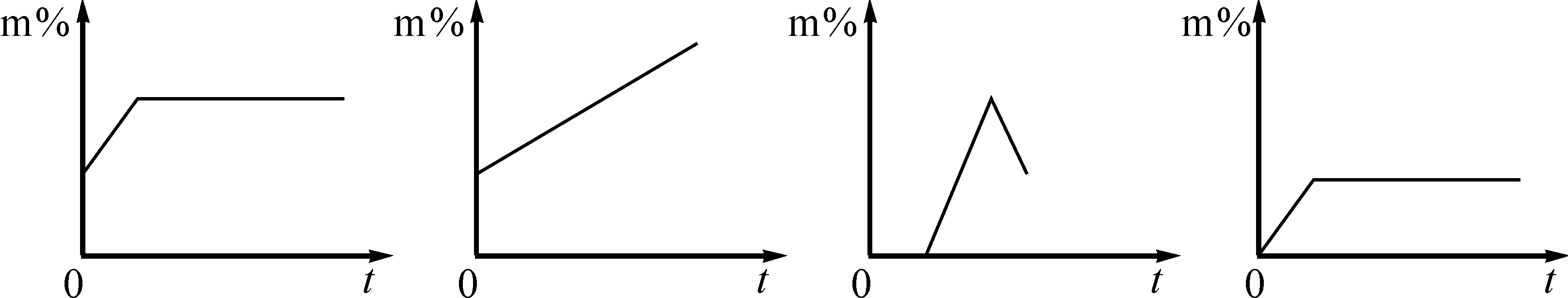
A B C D
【难度】中
【精析】温度不变,NaCl的溶解度不变,蒸发至饱和后溶液中溶质的质量分数不变,所以A正确。
【答案】A
【例题4】已知某物质在不同温度下的溶解度数据如下表所示。
温度(℃) | 0 | 20 | 40 | 60 | 80 |
溶解度(g) | 12.6 | 15.3 | 20.0 | 25.0 | 38.2 |
(1)如果要配制该物质溶质质量分数为20%的饱和溶液200克,需要水 克,此时溶液的温度应为 ℃;
(2)40 ℃时在100 g水中加入25 g该物质,充分溶解后所得溶液中溶质的质量分数为 。(精确到0.1%)
【难度】中
【精析】(1)需要水的质量为200 g(200 g×20%)=160 g,根据溶解度可知60 ℃时该物质的饱和溶液中溶质的质量分数为20%,所以此时溶液的温度为60 ℃;
(2)40 ℃时该物质的溶解度为20.0 g,所以40 ℃时在100 g水中加入25 g该物质,实际溶解的质量为20.0 g,所得溶液中溶质的质量分数为:![]()
【答案】(1)160 g 60 (2)16.7%
第二课时
【例题1】消毒是预防甲型H1N1流感的重要措施之一。某机场要用4500g溶质质量分数为2%的过氧乙酸溶液消毒,则需要溶质质量分数为15%的过氧乙酸溶液的质量是( )
A.30g B.60g C.90g D.600g
【难度】中
【精析】稀释前后溶质的质量不变。
解:设需要溶质质量分数为15%的过氧乙酸溶液的质量为X
4500g×2% = X×15%
X = 600g
【答案】D
【例题2】稀释溶质质量分数为98%(密度为1.84g/mL)的浓硫酸配制500mL溶质质量分数为20%的稀硫酸(密度为1.14g/mL),稀释时需用的水的体积约为( )
A.436.8mL B.453.7mL C.456.0mL D.458.3mL
【难度】中
【精析】
m(稀硫酸) = 500mLÏ1.14g/mL = 570g
m(浓硫酸)×98% = 570g×20%
m(浓硫酸) = 116.3g
稀释时需用水的质量为:570g – 116.3g
= 453.7g
稀释时需用水的体积为453.7mL
【答案】B
【例题3】某补钙品(有效成分为碳酸钙)的说明中标明含钙量为30%,李琳同学为了检验该产品,取10g补钙品放入100g稀盐酸中,HCl与补钙品的有效成分刚好完全反应(其它成分不与盐酸反应)。反应后剩余药品总质量比反应前减少了2.2g。求:
(1)补钙品中实际含钙的质量分数是多少?
(2)所用稀盐酸中溶质质量分数是多少?
【难度】难
【精析】解:设10g补钙品中含CaCO3的质量为 X,100g盐酸中含HCl的质量为Y。
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
100 73 44
X Y 2.2g
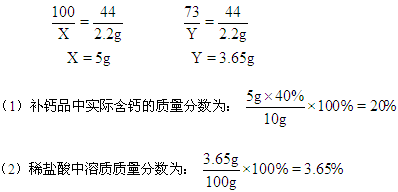
答:略
【答案】(1)20% (2)3.65%
【例题4】生铁是铁和碳的合金。为测定某炼铁厂生产的生铁样品中铁的质量分数,某化学兴趣小组的同学称得该生铁样品6.0g,放入烧杯中,向其中加入65.0g稀硫酸,恰好完全反应(假设杂质不参与反应也不溶于水)。测得的实验数据如下:
| 反应前 | 反应后 |
烧杯及其中物质的质量 | 97.0g | 96.8g |
请你完成有关计算(结果保留一位小数):
(1)反应放出氢气的质量是多少?
(2)生铁样品中铁的质量分数是多少?
(3)反应后所得溶液中溶质的质量分数是多少?
【难度】难
【精析】解:(1)m(H2) = 97.0g-96.8g = 0.2g
(2)设生铁中铁的质量为X,生成FeSO4的质量为Y
Fe + H2SO4 = FeSO4 + H2↑
56 152 2
X Y 0.2g

生铁中铁的质量分数为: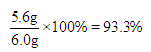
(3)反应后所得溶液溶质的质量分数为:![]()
答:略
【答案】(1)0.2g (2)93.3% (3)21.6%
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
- 上一篇:《溶液的浓度》知识全解
- 下一篇:《溶液的浓度》典例精析二
相关文章
-
没有相关内容


 会员登录
会员登录