《利用化学方程式的简单计算》典例精析二
【例1】在密闭容器中有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:
物质 | A | B | C | D |
反应前质量/g | 19.7 | 8.7 | 31.6 | 0.4 |
反应后质量/g | 待测 | 17.4 | 0 | 3.6 |
下列说法正确的是( )
A.物质C一定是化合物,物质D可能是单质
B.反应后密闭容器中A的质量是19.7 g
C.反应过程中,物质B与物质D变化的质量比为87︰36
D.若物质A与物质C的相对分子质量之比为197∶158,则反应中A与C的化学计量数之比为1∶2
【解析】根据表中数据可以看出,物质C反应后的质量比反应前的质量减少,所以C为反应物,在反应过程中C消耗的质量为31.6 g。B、D反应后的质量比反应前的质量增加,所以B、D为生成物,生成B的质量为17.4 g-8.7 g=8.7 g,生成D的质量为3.6 g-0.4 g=3.2 g,由于生成的B、D的质量和小于31.6 g,故A也是生成物,根据质量守恒定律,生成A的质量为31.6 g-8.7 g-3.2 g=19.7 g,反应后容器中A的总质量为19.7 g+19.7 g=39.4 g,由此可以得出该反应为分解反应,故选项A正确。选项B、C错误,将生成的A与参加反应的C的质量比换成化学计量数比,应为(19.7÷197)∶(31.6÷158)=1∶2,故选项D正确。
【答案】AD
【例2】在化学反应A+B=C+D中,已知16 gA与20 gB恰好完全反应生成21 gC,则生成D的质量为( )
A.25 g B.5 g C.15 g D.20 g
【解析】因为16 gA与20 gB恰好完全,根据质量守恒定律,生成C的质量为16 g+20 g-21 g=15 g,由此得出生成的D的质量为15 g。
【答案】C
【例3】在实验室用5.6 g铁与足量稀硫酸反应,可制得的氢气和硫酸亚铁的质量各是多少?
【解析】在化学反应中,反应物与生成物之间的质量比成正比例关系。所以,已知一种反应物(或生成物)的质量,可根据化学方程式,利用正比例关系,求出其他生成物(或反应物)的质量。
【答案】
解:设制得的氢气的质量为x,制得的硫酸亚铁的质量为y。
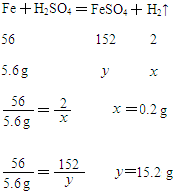
答:可制得的氢气的质量为0.2 g,同时制得的亚硫酸铁的质量为15.2 g。
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
相关文章
-
没有相关内容


 会员登录
会员登录