吉布斯自由能
在恒温恒压条件下,封闭系统的吉布斯自由能:ΔG=ΔH-TΔS。这一公式称为吉布斯等温方程式,是化学上最重要和最有用的公式之一。ΔG可作为反应或过程自发性的衡量标准:ΔG<0时,过程为自发过程;ΔG>0时,过程为非自发过程;ΔG=0时,处于平衡状态。
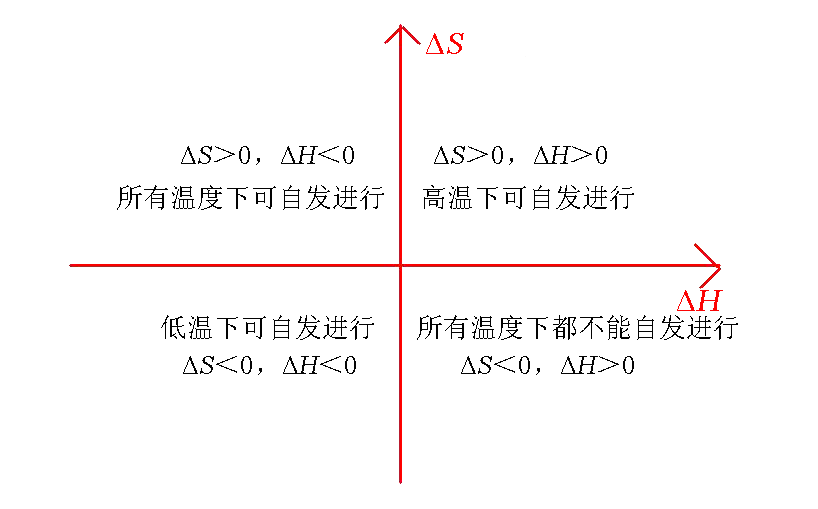
ΔG的符号和大小不但取决于ΔH和ΔS的符号和大小,也与温度密切相关,可能出现下表所示的四种情况。
ΔH、ΔS及T对反应自发性的影响
类型 | ΔH | ΔS | ΔG(ΔH-TΔS) | 正反应的自发性 | 实例 |
Ⅰ | - | + | 永远是负 | 任何温度均自发 | 2O3(g) |
Ⅱ | + | - | 永远是正 | 任何温度均不自发 | CO(g) |
Ⅲ | + | + | 低温为正 高温为负 | 低温非自发 高温自发 | CaCO3(s) |
Ⅳ | - | - | 低温为负 高温为正 | 低温自发 高温非自发 | N2(g)+3H2(g) |
从上表可以看出,类型Ⅰ的反应,ΔH为负值,ΔS为正值,即为焓减熵增的反应,不论温度多高,ΔG总是小于零,是负值,因此反应是自发的。类型Ⅱ的反应ΔH为正值,ΔS为负值,即为焓增熵减的反应,无论温度多高,ΔG总是大于零,因而反应总是不自发的。这两类反应中,焓效应和熵效应对ΔG的贡献(影响)是互相加强的,方向是一致的,因此温度因素不能改变ΔG的符号。类型Ⅲ和类型Ⅳ的反应,由于焓效应和熵效应对ΔG作出方向不同的贡献(影响),一般说来,低温焓效应影响为主,髙温熵效应影响为主,而温度影响的大小要看ΔH、ΔS的具体情况而定。
需要注意的是,一个体系的熵不能永远增加,最终会达到一个最大的无序状态,此时,体系呈现有确定的(不变的)性质,尽管分子水平上的变化仍在发生。我们讲的化学体系,当它具有不变的可观察的性质,就处在平衡状态,所以当一个体系ΔG=0时,即处于平衡状态。
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
- 上一篇:《化学反应进行的方向》双基训练题
- 下一篇:自发过程的焓判据
相关文章
-
没有相关内容


 会员登录
会员登录