键参数和分子的性质
键参数和分子的性质之间有一定的相关性。从键参数的数据可以归纳出某些定性的或半定量的规律用以说明分子的某些性质。所谓键参数指的是用于表征化学键性质的物理量,如键能、键长、键角等物理量的数据。
(1)键能
在101 kPa和25 ℃下,将1 mol理想气体分子AB拆开为中性气态原子A和B时,所需的能量叫做AB的离解能(单位为kJ/mol),以D(A—B)表示。例如,H2的离解能D(H—H)为436 kJ/mol。对双原子分子而言,离解能就是键能E,即E(H—H)=D(H—H)=436 kJ/mol,它是指破裂6.02×1023个键(单键)所需要的能量。键能是决定物质性质的一个重要因素。通常键能愈大,表明该化学键愈牢固,由该键组成的分子也就愈稳定。例如,HCl的键能E(H—Cl)=431.8 kJ/mol,HI的键能E(H—I)=298.7 kJ/mol,HCl比HI稳定,HI受热时就较易分解。
通常键能的数据是用热化学方法由实验测定的。
(2)键长
分子中两个原子核间的平均距离叫做键长(或核间距)。理论上用量子力学的近似方法可以算出键长。实际上通常是用光谱或衍射等实验方法来测定键长。
一般来说,两原子之间所形成的键愈短,键能就愈大,键愈强,愈牢固。综上所述,可以用键能和键长二个键参数定量地描述化学键的特征。
(3)键角
键角系指分子中键与键之间的夹角。键角是表示分子空间结构的一个重要参数。例如,H2S分子中2个S—H键之间的夹角是92°,这表明H2S分子是V形结构。
一般来说,如果已知某分子中的键长和键角的数据,就可确定该分子的几何构型(分子在空间呈现的几何形状)。例如,已知CO2分子的C=O键长是0.116 nm,O—C—O键角等于180°,就可得知CO2分子是直线形的非极性分子,据此也可推断它的物理性质。又如,已知NH3分子里的H—N—H键角是107°18′,N—H键长是0.102 nm,就可推断NH3分子是三角锥形的极性分子。
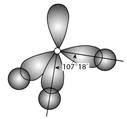
图1氨分子结构示意图
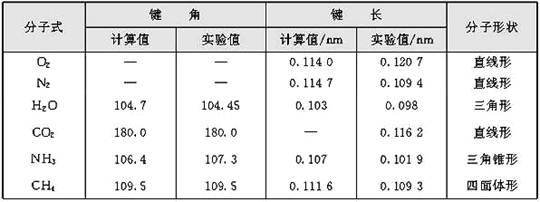
理论上可用量子力学近似方法算出键角,但对于复杂分子来说,实际上是通过光谱、衍射等结构分析实验测定而算出。表1是某些分子的键长和键角的数据。
表1某些分子的键长和键角数据
2. 在共价化合物中形成弱极性键或强极性键是由哪些因素来决定的?电负性差值达到什么程度,极性键就转变为离子键?
在共价化合物中,由于不同元素的原子吸引电子的能力不同,共用电子对就必然或多或少地偏向于对它吸引力较大的那个原子(即电子云密度大的地方将偏近于这个原子),所以形成的键就具有不同程度的极性。两种元素的电负性相差越大,它们之间键的极性就越强,其中,电负性较大的原子为负极,电负性较小的原子为正极。例如,卤素中氟的电负性为4.0,氯为3.0,溴为2.8,碘为2.5,而氢的电负性为2.1。显然,在卤化氢分子中键的极性强弱的程度应为:
HF>HCl>HBr>HI
其中H—F和H—Cl为强极性键,H—I为弱极性键,而H—Br则介于两者之间。卤素原子是负极,氢原子是正极。又如CH4中的C—H键,由于碳的电负性为2.5,与氢的相差很小,所以是弱极性键,碳是负极,氢是正极。
电负性差值与键的极性之间有没有严格的定量关系?电负性差值达到什么程度,极性键就转变为离子键?对于诸如此类的问题,很难做出肯定的回答,因为在离子键和共价键之间没有一条绝对分明和固定不变的界限。
近代实验表明,即使在由电负性最小的铯和电负性最大的氟形成的最典型的离子型化合物氟化铯中,键的离子性也不是百分之百,而只有92%。我们可以用离子性百分数来表示键的离子性相对于共价性的大小。对于AB型化合物单键离子性百分数和电负性差值(XA—XB)之间的关系如表2所示。
表2单键的离子性百分数与电负性差值之间的关系
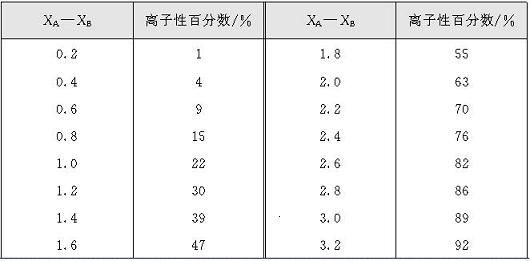
从表2可知,当两个原子电负性差值约为1.7时,单键约具有50%的离子性,这是一个重要的参考数据。如果两个原子电负性差值大于1.7时,可判断它们之间主要形成离子键,该物质是离子型化合物;如果两个原子电负性差值小于1.7,则可判断它们之间主要形成共价键,该物质为共价化合物。例如钠的电负性为0.9,氯的电负性为3.0,两原子的电负性差值为2.1,当它们互相结合成NaCl时,其键的离子性百分数约为70%。因此可以判断氯化钠中钠离子与氯离子之间主要是形成离子键,氯化钠为离子型化合物。
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
- 上一篇:《共价键》知识全解
- 下一篇:选修3名校试题精编精析2.1《共价键》
相关文章
-
没有相关内容


 会员登录
会员登录