实验室制取二氧化碳的问题解析
一、实验室制取二氧化碳时,为什么最好选用石灰石(或大理石)和稀盐酸?
所有的碳酸盐都能与盐酸反应产生二氧化碳。常见的Na2CO3、K2CO3与盐酸反应时速率太快,不易控制。块状的碳酸镁(MgCO3)跟盐酸反应时速率适中,但来源不广泛。石灰石与大理石的主要成分都是碳酸钙,它们与盐酸反应时速率适中,易于控制,且来源广泛,容易得到。使用时应把大理石或石灰石砸成大小适当的块状,以便在气体发生装置中使用。
选用药品相互反应制取气体时,应尽量避免混入杂质气体。盐酸是挥发性酸,浓度越大时挥发性越强,制取二氧化碳时不用浓盐酸而用稀盐酸,就是为了尽量减少挥发出来的氯化氢混入二氧化碳。
二、为什么不能用硫酸或硝酸代替盐酸?
盐酸与CaCO3反应生成氯化钙、CO2和水,由于氯化钙易溶于水,保证了CaCO3与盐酸的顺利接触,使反应能够持续进行,顺利地产生二氧化碳。
硫酸与碳酸钙反应时虽也能生成二氧化碳,但生成物中有微溶于水的硫酸钙(CaSO4),它覆盖在大理石或石灰石的表面,把碳酸钙包在其中,使硫酸与碳酸钙的接触受阻,不能顺利发生反应,因而反应速率越来越慢,甚至停止反应。故在实验室制取二氧化碳时不能使用硫酸。硝酸是一种不稳定的挥发性酸。当硝酸与碳酸钙反应时,由于放出的热促使硝酸分解成二氧化氮、氧气和水,制得的二氧化碳中会含有这些杂质气体。同时,挥发出的硝酸蒸气、二氧化氮都对制取装置上的橡皮塞、橡皮导管有较强的腐蚀作用,因此在实验室制取二氧化碳时不用硝酸。
三、怎样制得纯净而又干燥的二氧化碳?
从气体发生装置中出来的二氧化碳中,一般都含有少量的盐酸酸雾(HCl)和水蒸气。要除去CO2中混有的HCl和H2O,可让气体先通过一个盛饱和碳酸氢钠溶液的洗气瓶以除去HCl气体,然后再通过一个盛浓硫酸的洗气瓶以除去水蒸气,如图所示,这样两只串联在一起的洗气瓶就构成了净化装置。
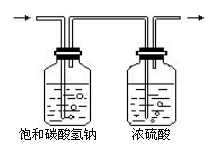
四、收集二氧化碳时,怎样知道集气瓶中已充满了二氧化碳?
二氧化碳能溶于水且密度比空气大,通常不采用排水法收集,而采用向上排空气法收集。若要检验集气瓶内是否充满了二氧化碳,可用两种方法:①用燃着的火柴或木条放在集气瓶口,如果火焰熄灭,就证明集气瓶中已经充满了二氧化碳;②用玻璃棒蘸取澄清的石灰水或氢氧化钡[Ba(OH)2]饱和溶液,接近集气瓶口,如果溶液出现白色浑浊,则表明集气瓶内已充满了二氧化碳。有关反应的化学方程式为:
Ca(OH)2+CO2=CaCO3↓+H2O
Ba(OH)2+CO2=BaCO3↓+H2O
这两种方法都很方便,效果也都不错。
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
- 上一篇:没有了!
- 下一篇:实验室制取二氧化碳析疑
相关文章
-
没有相关内容


 会员登录
会员登录