共轭大π键
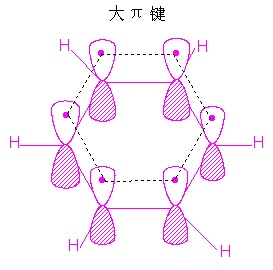
(1)苯分子中的p-p大π键
苯的路易斯结构式里的碳碳键有单键和双键之分,这种结构满足了碳的四价,然而,事实上,苯分子里所有碳碳键的键长和键能并没有区别,这个矛盾可用苯环的碳原子形成p-p大π键的概念得以解决——苯分子中的碳原子取sp2杂化,3个杂化轨道分别用于形成3个σ键,故苯分子有键角为120°的平面结构的σ骨架;苯分子的每个碳原子还有一个未参与杂化的p轨道,垂直于分子平面而相互平行。显然,每个碳原子左右相邻的碳原子没有区别,认为某个碳原子未参与杂化的p轨道中的电子只与左邻碳原子的平行p轨道中的一个电子形成π键而不与右邻碳原子的平行p轨道形成π键或者相反显然是不符合逻辑的,可以认为所有6个“肩并肩”的平行p轨道上总共6个电子在一起形成了弥散在整个苯环的p-p大π键(如图)。
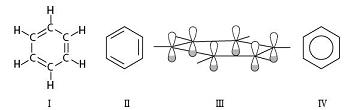
(Ⅰ路易斯结构式;Ⅱ结构简式;Ⅲ分子中有6个平行p轨道;Ⅳ大π键的结构式)
苯分子的大π键
(2)丁二烯中的p-p大π键
丁二烯分子式为H2C=CH—CH=CH2。4个碳原子均与3个原子相邻,故均取sp2杂化,这些杂化轨道互相重叠,形成分子的σ骨架,使所有原子处于同一个平面。每个碳原子还有一个未参与杂化的p轨道,垂直于分子平面,每个p轨道里有一个电子。按照上面分析苯分子结构的方式,丁二烯分子里存在一个“4轨道4电子”的p-p大π键(如图)。
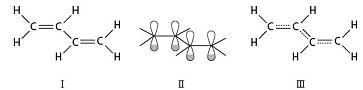
(Ⅰ路易斯结构式;Ⅱ分子中有4个平行p轨道;Ⅲ大π键的结构式)
丁二烯分子中的p-p大π键
通常采用Πab为大π键的符号,其中a表示平行p轨道的数目,b表示在平行p轨道里的电子数。理论计算证明,形成大π键的必要条件是b<2a,若b=2a便不能形成大π键。上面两个例子都是b=a,苯分子的大π键的符号为Π66,丁二烯分子的大π键的符号为Π44,但有的大π键中的电子数不等于轨道数。
(3)CO2分子里的大π键
根据VSEPR理论模型,CO2属于AX2E0型分子,是直线形的,在中心原子碳原子上没有孤对电子。根据杂化轨道理论,CO2的碳原子取sp杂化轨道。如前所述,当某原子取sp杂化轨道时,它的两个未参加杂化的p轨道在空间的取向是跟sp杂化轨道的轴呈正交关系的,即相互垂直,因而CO2分子有两套相互平行的p轨道,每套3个p轨道,每套是3轨道4电子,换言之,CO2分子里有两套3原子4电子符号为Π34的p-p大π键。
计算大π键里的电子数的方法很多,一种方法的步骤是:①确定分子中总价电子数;②画出分子中的σ键以及不与π键p轨道平行的孤对电子轨道;③总电子数减去这些σ键电子和孤对电子,剩余的就是填入大π键的电子。如上所述,二氧化碳分子有16个价电子,每个氧原子上有1个容纳孤对电子的轨道不与π键p轨道平行,这些轨道总共容纳8个电子,因此2套平行p轨道里总共有8个电子,平均每套p轨道里有4个电子(如图)。
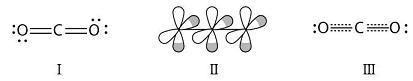
(Ⅰ路易斯结构式;Ⅱ分子中有2套平行p轨道;Ⅲ大π键的结构式)
CO2中的大π键
另一种计算大π键中电子数的方法是:把大π键看成路易斯结构式中的π键与邻近原子的平行p轨道中的孤对电子“共轭”,参加“共轭的”电子就是大π键中的电子。例如,二氧化碳的每一个π键与邻近的一个氧原子的平行p轨道上的1对孤对电子共轭,所以每一套平行的3个p轨道上有4个电子。
(4)CO32-中的大π键
根据VSEPR理论,碳酸根离子属于AX3E=AY3型分子,它的VSEPR理想模型是平面三角形,分子中的3个C—O σ键呈平面三角形;按杂化轨道模型,中心碳原子有3个σ轨道,取sp2杂化形式,碳原子上还有一个垂直于分子平面的p轨道;端位的3个氧原子也各有1个垂直于分子平面的p轨道;分子的总价电子数等于24,3个C—O σ键有6个电子,每个氧原子上有2个不与分子平面垂直的孤对电子对,因此4个平行p轨道中共有24-6-3×4=6个电子,所以CO32-离子中有1个4轨道6电子pp大π键,符号为Π46(如图)。
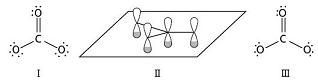
(Ⅰ路易斯结构式;Ⅱ分子中4个平行p轨道;Ⅲ标出了除大π键外的12个电子)
CO32-的结构
(5)O3分子中的大π键
根据VSEPR理论臭氧分子属于AX2E型分子,它的VSEPR理想模型是平面三角形(包括氧原子上的孤对电子对)。根据杂化轨道理论,臭氧分子的中心氧原子有3个σ轨道(2个σ键和1个占据σ轨道的孤对电子对),取sp2杂化形式,中心氧原子还有一个垂直于分子平面的p轨道,端位的每个氧原子只可能有一个垂直于分子平面的p轨道,另外2对孤对电子占据的轨道在分子平面上,因此,3个平行p轨道中的电子数为18-2×3-2×4=4,臭氧分子里有一个Π34大π键(如图)。
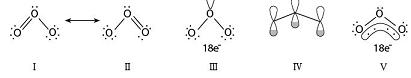
(Ⅰ和Ⅱ为路易斯结构式;Ⅲ标出了总电子数;Ⅳ表明3个平行p轨道;Ⅴ大π键的结构式)
臭氧的分子结构
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
- 上一篇:关于分子中八个电子稳定结构题目的解题方法
- 下一篇:《分子的立体结构》知识全解
相关文章
-
没有相关内容


 会员登录
会员登录