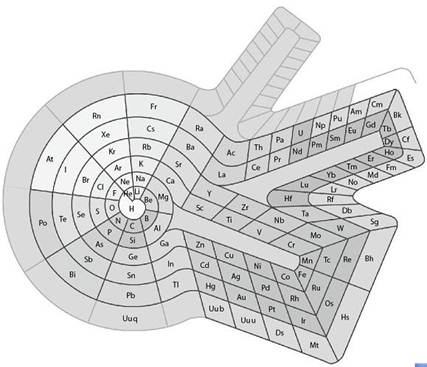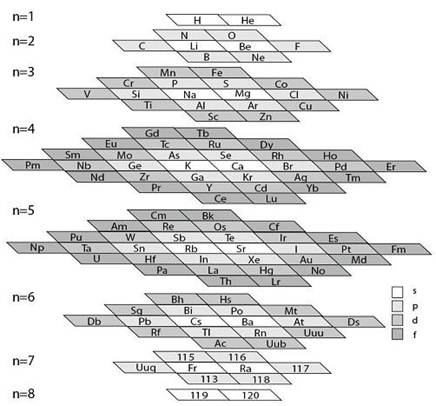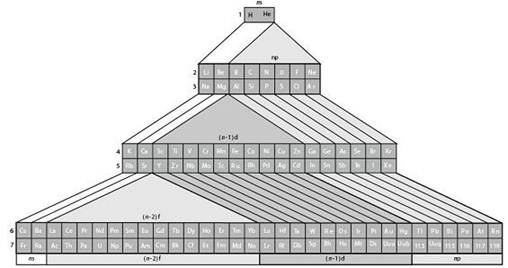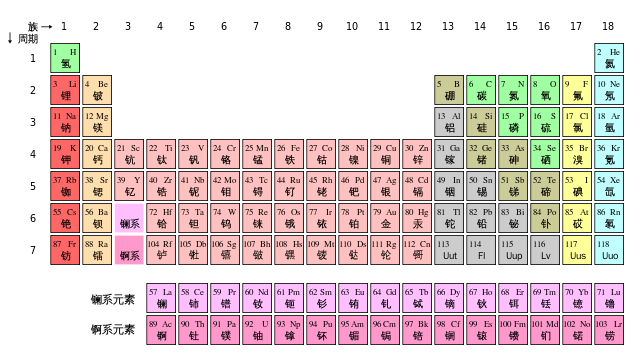
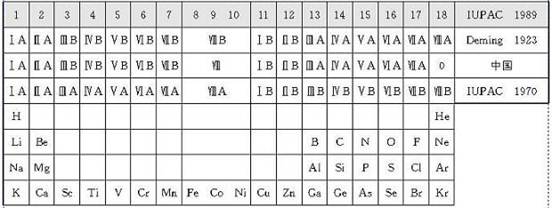
1. 长式周期表中主副族的划分
近年来,长式周期表为许多国家所采用。但是在这种周期表中关于主族和副族的划分方法,曾引起过争议。1923年,戴明(Deming)把包含典型元素的族定为主族,在族序数后标以符号A,把过渡元素的各族定为副族,在族序数后标以符号B。我国基本上采用Deming的划分法,只是把稀有气体定为0族,而且对它和第Ⅷ族均不划分主、副族,不标A、B符号。另一种划分法是把碱金属、碱土金属和除铜族、锌族外的过渡元素均定为主族,标以符号A,把铜族、锌族以及其后的各族均定为副族,标以符号B。1970年国际纯粹和应用化学联合会(IUPAC)支持这种划分法。由于在长式周期表中主、副族的划分方式不一致,在学术界引起了混乱。因此,在1989年国际纯粹和应用化学联合会建议不再划分主、副族,把长式周期表的各族自左至右统一编号为1~18列。现在许多国家已经采用了这种表述形式。长式周期表主副族元素划分方式的演变见表1-1。
在长式周期表中氢的位置也有一个演变过程。从前把氢放在长式周期表的上中部,以两条线分别跟碱金属和卤素相连,表示氢既跟碱金属相似,又跟卤素相似。另一些周期表把氢放在碱金属或者卤素的顶部,个别的还在碱金属和卤素的顶部都标上氢。1989年,国际纯粹和应用化学联合会推荐的18列周期表中,把氢列在碱金属的顶部,这跟近年来研究金属氢取得进展及制得Na-(相当于H-)化合物、发现锂键(相当于氢键)等有关。
表1-1长式周期表主副族划分方式的演变
2. 元素周期系的远景
元素的存在,是与原子结构的稳定性,特别是与原子核的稳定性有关。人们发现,原子序数大于83(铋之后)的元素,都是放射性元素,而原子序数在92之后(超铀元素)的元素,全部是用人工方法合成的元素(Np、Pu在自然界中也有,但含量极微)。目前已公认了112号元素的合成方法。人们要问:新的人工合成的元素究竟还可以合成多少种?
物理学家根据原子核结构理论计算,认为周期系最后可能出现的是原子序数为175的元素。人工合成的元素,将会完成第七周期(零族元素的原子序数应为118),并进入第八周期,甚至第九周期。在未来的第八、九周期中,原子中的电子依次填充新的能级——5g能级和6g能级。依照已有的规律,可以推知g能级最多能容纳18个电子。
能级: s p d f g
电子数:2 6 10 14 18
由此可以预见,第八、九周期都将有50种元素,是超长周期。在这两个周期里,将有“超锕系”和“新超锕系”的5g~6f和6g~7f内过渡系(各为32种元素)。
3. 同周期和同族元素的第一电离能
(1)同周期元素
表1-3是二、三周期部分元素的核外电子排布和第一电离能,图1-5是第二周期和第三周期元素的第一电离能。
表1-3 第二、三周期部分元素的核外电子排布和第一电离能
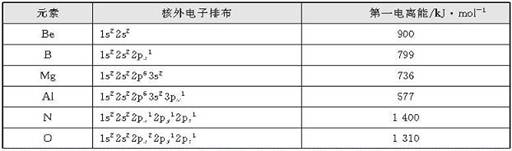
图1-5第二、三周期元素的第一电离能
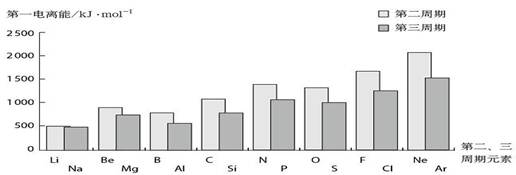
①同周期元素的第一电离能,从左到右递变的总趋势是依次增大,原因是核电荷数增多,而能层数不变,核电荷对核外电子的吸引力增大;
②为什么B的第一电离能反而比Be小?原因是B失去的电子是2p电子,2p电子的轨道能比2s电子的轨道能高;同理,Al的第一电离能比Mg的第一电离能小;
③氧的第一电离能为什么反而比氮的第一电离能小?原因是氧的第一电离能是失去已经成对的2p电子所需能量,成对电子的相互排斥的能量比核电荷增加吸引2p电子的能量还大,导致氧的第一电离能反比氮的第一电离能低;同理,硫的第一电离能反而小于磷的第一电离能。
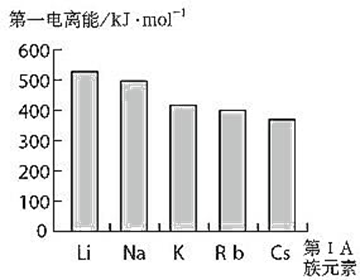
图1-6第ⅠA族元素的第一电离能
(2)同族元素
图1-6是碱金属元素的第一电离能。
一般来说,同主族元素的第一电离能,从上到下递变的总趋势是依次降低,原因是核外电子的层数增加而且原子半径递增,核电荷对最外层电子的吸引力降低。
应当注意的是,副族元素的第一电离能从上到下变化趋势与主族不相同,大多是从上到下第一电离能反而增加,原因是虽然核外电子层数增加但原子半径增加却不显著甚至减小,导致核电荷对最外层电子的吸引力增加。