《金属的化学性质》典例精析二
1.某学生将一小块钠投入滴有酚酞的水中,此实验能证明钠下面4点性质中的( )
①钠的密度比水的小 ②钠的熔点较低 ③钠与水反应时放出热量 ④钠与水反应后溶液是呈碱性
A.①④ B.①②④
C.①③④ D.①②③④
【解析】Na与水反应时,Na融化成闪亮的小球,在水面四处游动,同时溶液使酚酞变红色。体现了①②③④四点性质。
【答案】D
2.某同学将金属钠露置于空气中,观察到下列现象:![]() ,根据钠及其化合物的性质分析,下列说法正确的是( )
,根据钠及其化合物的性质分析,下列说法正确的是( )
A.①发生了氧化还原反应
B.①变灰暗色是因为生成了过氧化钠
C.③是碳酸钠吸收空气中的水蒸气形成了溶液
D.④只发生物理变化
【解析】①变灰暗是因为钠与氧气反应生成了氧化钠,发生了氧化还原反应,A正确,B错误;③是氢氧化钠吸收空气中的水蒸气形成了溶液,C错误;④中氢氧化钠与空气中的CO2反应生成了碳酸钠,发生了化学变化,D错误。
【答案】A
3.用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图所示),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升,根据实验现象判断下列说法错误的是( )
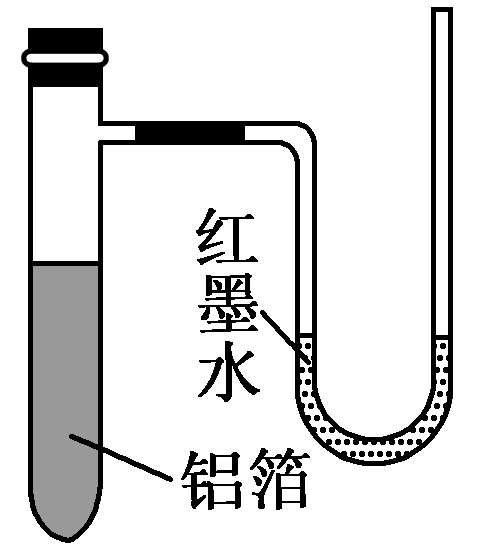
A.实验中发生的反应都是氧化还原反应
B.铝是一种较活泼的金属
C.铝与氧气反应放出大量的热量
D.铝片上生成的白毛是氧化铝和氧化汞的化合物
【解析】铝是一种活泼金属,当表面的氧化铝保护膜被破坏后,铝在空气中极易与氧气反应生成Al2O3,该反应是放热反应,从而使反应体系的温度升高,压强增大,红墨水柱右端上升,铝浸入硝酸汞溶液中,发生反应2Al+3Hg2+=2Al3++3Hg,生成的汞覆盖在表面,汞不活泼,很难与氧气反应生成氧化汞.
【答案】D
4.在托盘天平两端的烧杯中加入同浓度同体积的足量盐酸,当向两个烧杯中分别加入0.1 mol两种金属充分反应后,而在某一端要再放一个0.2 g砝码,天平才能平衡,则这两种金属是( )
A.Mg和Al B.Al和Fe
C.Fe和Cu D.Na和Mg
【解析】由于在托盘天平两端的烧杯中加入同浓度同体积的足量盐酸,当加入两种不同金属时反应后两者质量相差0.2克,加入0.1 mol镁时会使溶液增重2.4 g-0.2 g=2.2 g;加入0.1 mol铝时会使溶液增重2.7 g-0.3 g=2.4 g,两盘相差0.2 g,所以A正确.
【答案】A
5.用铝箔包裹0.1 mol金属钠,用针孔扎若干个小孔,放入水中,完全反应后,放出的气体体积(标准状况)为( )
A.无法确定 B.1.12 L
C.大于1.12 L D.小于1.12 L
【解析】首先发生的反应是:2Na+2H2O=2NaOH+H2↑,0.1 mol Na产生标准状况下的H2 1.12 L,后发生的反应是:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,此反应又能产生部分H2。
【答案】C
6.将钠、镁、铝各0.3 mol分别放入100 mL 1 mol/L的盐酸中,在同温、同压下产生的气体体积比是( )
A.1∶2∶3 B.6∶3∶2
C.3∶1∶1 D.1∶1∶1
【解析】0.3 mol Na、Mg、Al对100 mL 1 mol·L-1的盐酸都过量,产生的H2应该由盐酸决定,盐酸的量相等时Mg、Al产生的H2为![]() ,但钠与水还可以反应,故0.3 mol Na全部反应后产生的H2应为0.15 mol,所以三者产生的气体体积比应为
,但钠与水还可以反应,故0.3 mol Na全部反应后产生的H2应为0.15 mol,所以三者产生的气体体积比应为![]()
【答案】C
7.下图是研究某反应产物的示意图,锥形瓶中盛装的是某种固体或溶液,小烧杯中盛有少量某种固体,分液漏斗内盛有过量的某种液体,U形管内装有有色液体,装置气密性良好。若锥形瓶内是Na2CO3溶液,分液漏斗内的液体是盐酸或NaOH溶液,向烧杯内滴加盐酸或NaOH溶液时,发现U形管内液体右移(不考虑反应过程中的热量变化),静止后液面左边低于右边,则烧杯内的物质是( )
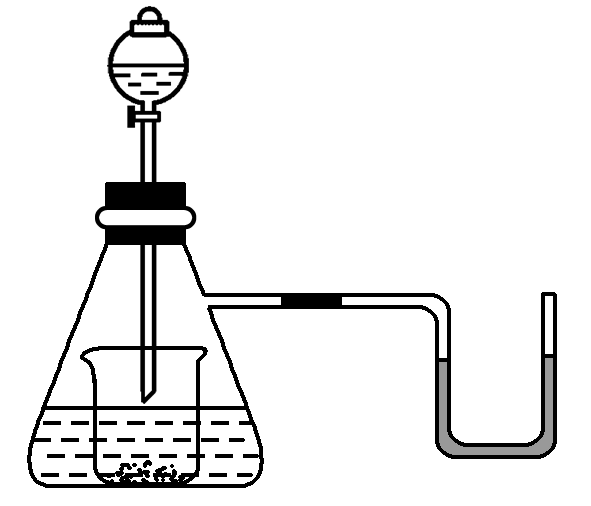
A.过氧化钠 .碳酸氢钠 C.铝 D.铁
【解析】烧杯内的物质是铝,向烧杯内迅速滴加盐酸或NaOH溶液时,均产生H2,但由于H2不溶于水,所以造成锥形瓶内压强增大,U形管内液体右移,最后液面左边低于右边.
【答案】C
8.(1)分别取W克钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是 ;
(2)分别取0.1 mol钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是 ;
(3)若产生相同物质的量的氢气,所需钠、铁、铝的质量比是 ;
(4)若产生相同体积(同温同压)的氢气,所需钠、铁、铝三种金属的物质的量之比是 。
【解析】(1)W克钠、铁、铝的物质的量分别为![]() 由电子得失转移守恒可得,2 mol钠生成1 mol氢气,1 mol铁生成1 mol氢气,2 mol铝生成3 mol氢气,所以生成氢气的体积比为
由电子得失转移守恒可得,2 mol钠生成1 mol氢气,1 mol铁生成1 mol氢气,2 mol铝生成3 mol氢气,所以生成氢气的体积比为![]() 同理可得到(2)、(3)、(4)的答案.
同理可得到(2)、(3)、(4)的答案.
【答案】(1)![]() (2)1∶2∶3(3)23∶28∶9(4)6∶3∶2
(2)1∶2∶3(3)23∶28∶9(4)6∶3∶2
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
- 上一篇:《金属的化学性质》典例精析一
- 下一篇:《几种重要的金属化合物》典例精析一
相关文章
-
没有相关内容


 会员登录
会员登录