《金属的化学性质》典例精析一
【例1】在一定条件下,将钠与氧气反应的生成物1.5 g溶于水,所得溶液恰好能被80 mL浓度为0.50 mol/L的HCl溶液中和,则该生成物的成分是( )
A.Na2O B.Na2O2 C.Na2O和Na2O2 D.Na2O2和Na2O
【解析】依题意可知HCl为0.04 mol。钠的氧化物若为Na2O,应为0.02 mol×62 g·mol-1=1.24 g;若为Na2O2,应为0.02 mol×78 g·mol-1=1.56 g。1.5 g介于1.24 g与1.56 g之间,应为二者的混合物。
【答案】C
【例2】铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH物质的量之比为( )
A.3︰1 B.2︰1 C.1︰1 D.1︰3
【解析】铝与盐酸和NaOH溶液反应的离子方程式分别为:
2Al+6H+=2Al3++3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
相同状况下,产生H2的体积相等,则H2的物质的量相等,那么,消耗的H+与OH-物质的量之比为3︰1,即消耗HCl和NaOH物质的量之比为3︰1。
【答案】A
【例3】下列关于金属铝的叙述中,说法不正确的是( )
A.Al是地壳中含量最多的金属元素
B.A1是比较活泼的金属,在化学反应中容易失去电子,表现还原性
C.铝箔在空气中受热可以熔化,且发生剧烈燃烧
D.铝箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al并不滴落
【解析】Al是比较活泼的金属,其原子结构为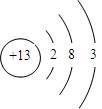 ,易失去最外层电子,有较强的还原性。Al的熔点较低(660 ℃),但其氧化物的熔点很高(2 050 ℃),所以铝箔加热时,Al熔化但被氧化膜包住,不会滴落。
,易失去最外层电子,有较强的还原性。Al的熔点较低(660 ℃),但其氧化物的熔点很高(2 050 ℃),所以铝箔加热时,Al熔化但被氧化膜包住,不会滴落。
【答案】C
【例4】下列实验操作中,溶液里无固体析出的是( )
A.MgCl2溶液中加入Na的小颗粒
B.Ca(OH)2饱和溶液中加入Na的小颗粒
C.KNO3稀溶液中加入Na的小颗粒
D.水中加入Na的小颗粒
【解析】四项实验操作中都有化学反应:2Na+2H2O=2Na++2OH-+H2 ↑,并且反应放出热量,使溶液温度升高。由于Mg(OH)2难溶于水,所以在A项中还有化学反应:Mg2++2OH-=Mg(OH)2↓,B项中的Ca(OH)2溶液已是饱和的,反应又消耗水(溶剂),必有Ca(OH)2固体析出。
【答案】CD
【例5】由Zn、Fe、Al、Mg四种金属中的两种组成的混合物10 g,与足量的盐酸反应产生的H2在标准状况下为11.2 L,则混合物中一定含有的金属是 。
【解析】用极值思想和金属与酸反应产生H2的关系式,很容易求解。
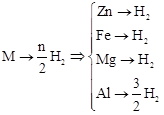
由此很快算出,产生标准状况下11.2 L的H2时,需要各金属的质量分别是:
m(Zn)=32.5 g,m(Fe)=28 g,m(Mg)=12 g,m(Al)=9 g<10 g。
只有当Al与其他任意一种金属混合才可能符合题意要求。
【答案】Al
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
- 上一篇:《几种重要的金属化合物》本节课本插图14幅
- 下一篇:《金属的化学性质》典例精析二
相关文章
-
没有相关内容


 会员登录
会员登录