元素周期表、元素周期律知识精华
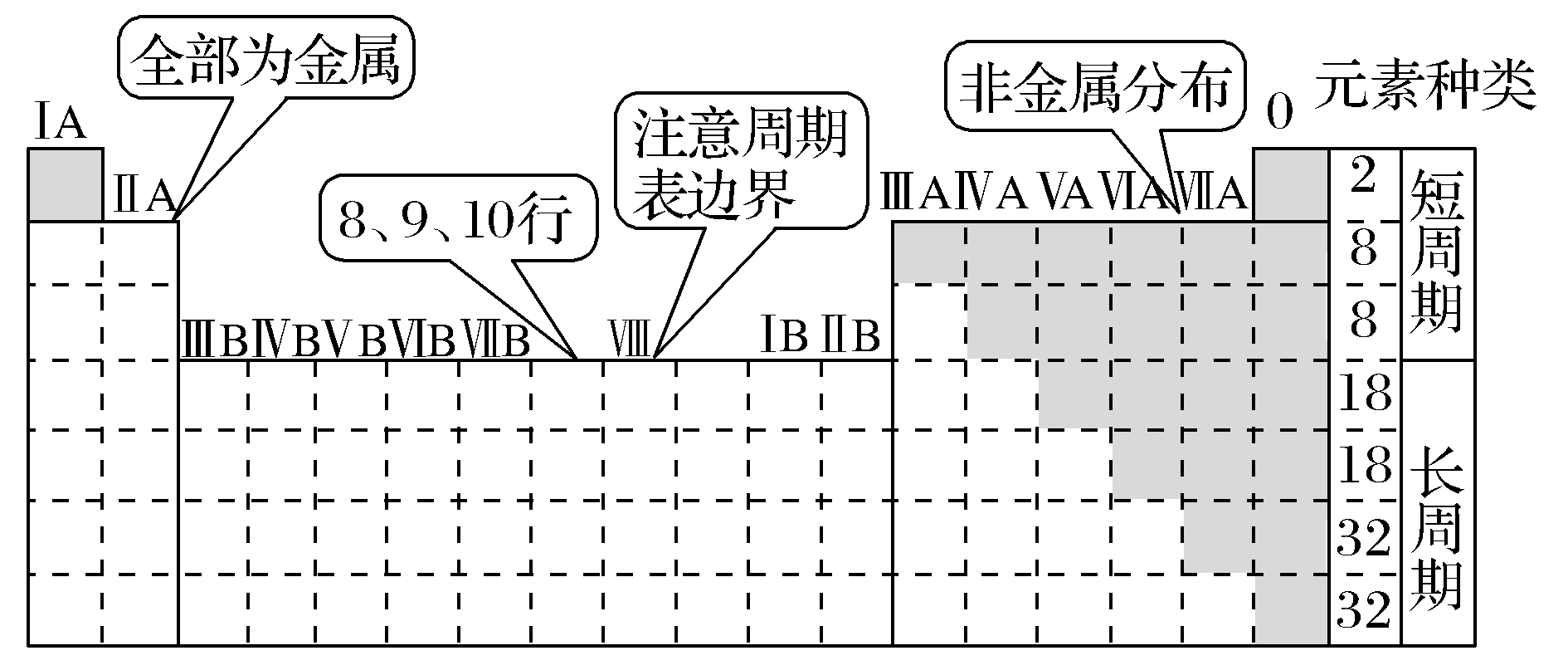
1.识记:元素周期表的结构
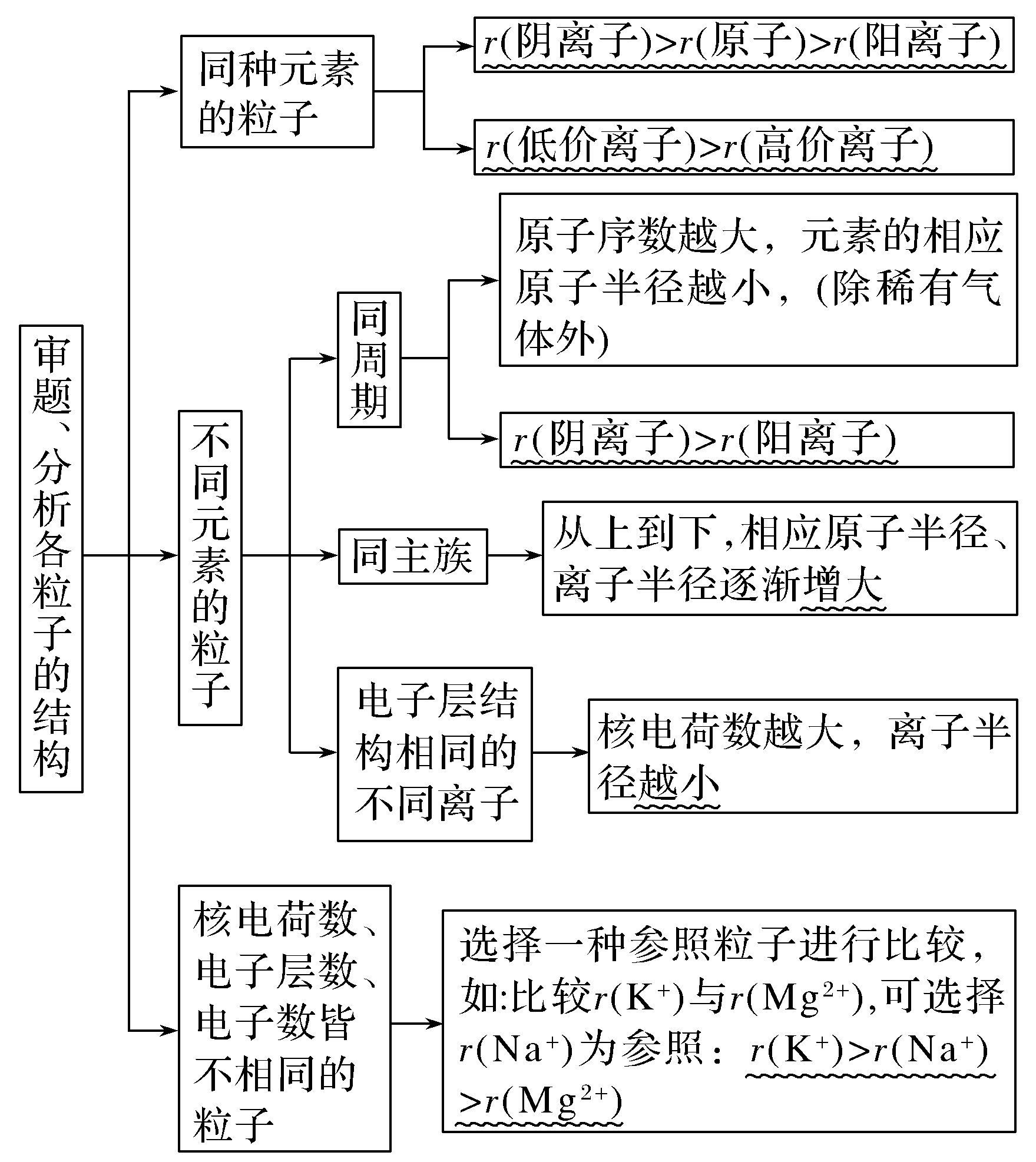
2.比较:半径大小
3.比较:金属性、非金属性
比较金属性和非金属性的强弱,主要有以下三种方法
(1)结构比较法
最外层电子数越少,电子层数越多,元素金属性越强;最外层电子数越多,电子层数越少,非金属性越强。
(2)位置比较法
元素周期表 | 金属性“右弱左强,上弱下强,右上弱左下强” |
非金属性“左弱右强,下弱上强,左下弱右上强” | |
金属活动性顺序 | 按K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、Cu、Hg、Ag、Pt、Au的顺序,金属性减弱 |
非金属活动性顺序 | 按F、O、Cl、Br、I、S的顺序,非金属性减弱 |
(3)实验比较法

状元体会
对元素周期表的结构不能烂熟于心,尤其对特殊元素,如H虽属非金属,但与碱金属同主族,O无最高正价,F无正价;对常见元素化合物的性质不熟悉,也是造成元素推断时犯错的重要原因;另外还存在着认识上的失误。如(1)误认为最高正价和最低负价相等的只有第ⅣA族,忽视了第ⅠA族的氢元素;(2)误认为元素的非金属性越强,其氧化物对应水化物的酸性越强,忽视了“最高价”这一关键词;(3)误认为失电子难的原子得电子能力一定强,忽视了稀有气体的性质;(4)误认为同周期第ⅡA族、第ⅢA族元素原子序数之差都等于1,忽视了长周期相差11或25。
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
- 上一篇:原子结构及化学键知识精华
- 下一篇:元素综合推断知识精华
相关文章
-
没有相关内容


 会员登录
会员登录