原子结构及化学键知识精华
1.区分:元素、核素、同位素之间的关系

2.知记:
(1)微粒间“四个”数量关系
①质子数=核电荷数=核外电子数=原子序数。
②质量数=质子数+中子数
③质子数=阳离子的核外电子数+阳离子所带正电荷数。
④质子数=阴离子的核外电子数-阴离子所带负电荷数。
(2)10电子微粒和18电子微粒
①10电子微粒

若10电子微粒满足关系: 则一定是NH4++OH-=NH3↑+H2O。
则一定是NH4++OH-=NH3↑+H2O。
②18电子微粒
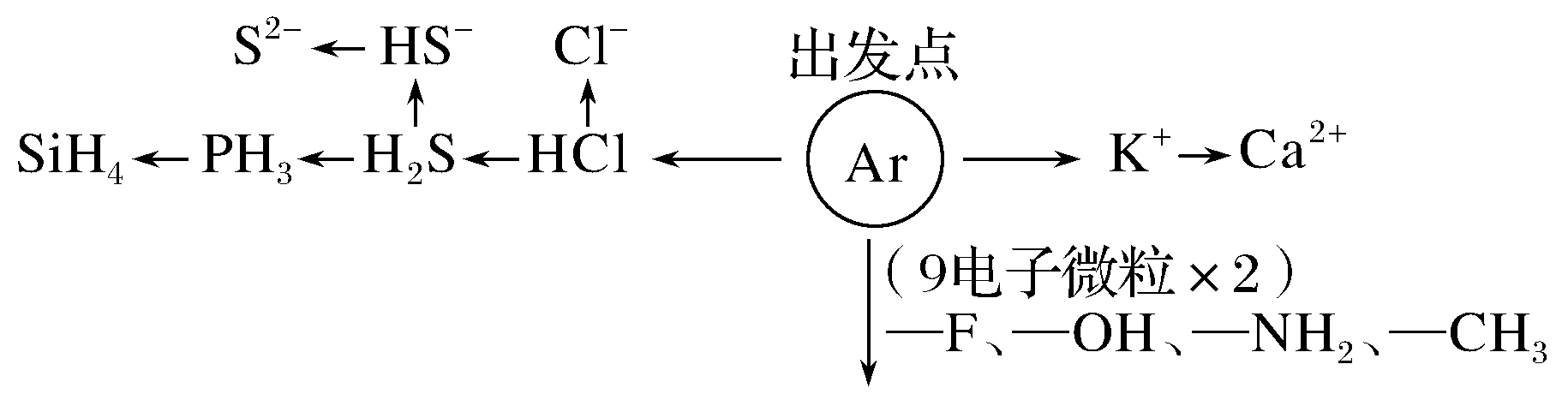
CH3—CH3、H2N—NH2、HO—OH、F—F、F—CH3、CH3—OH……
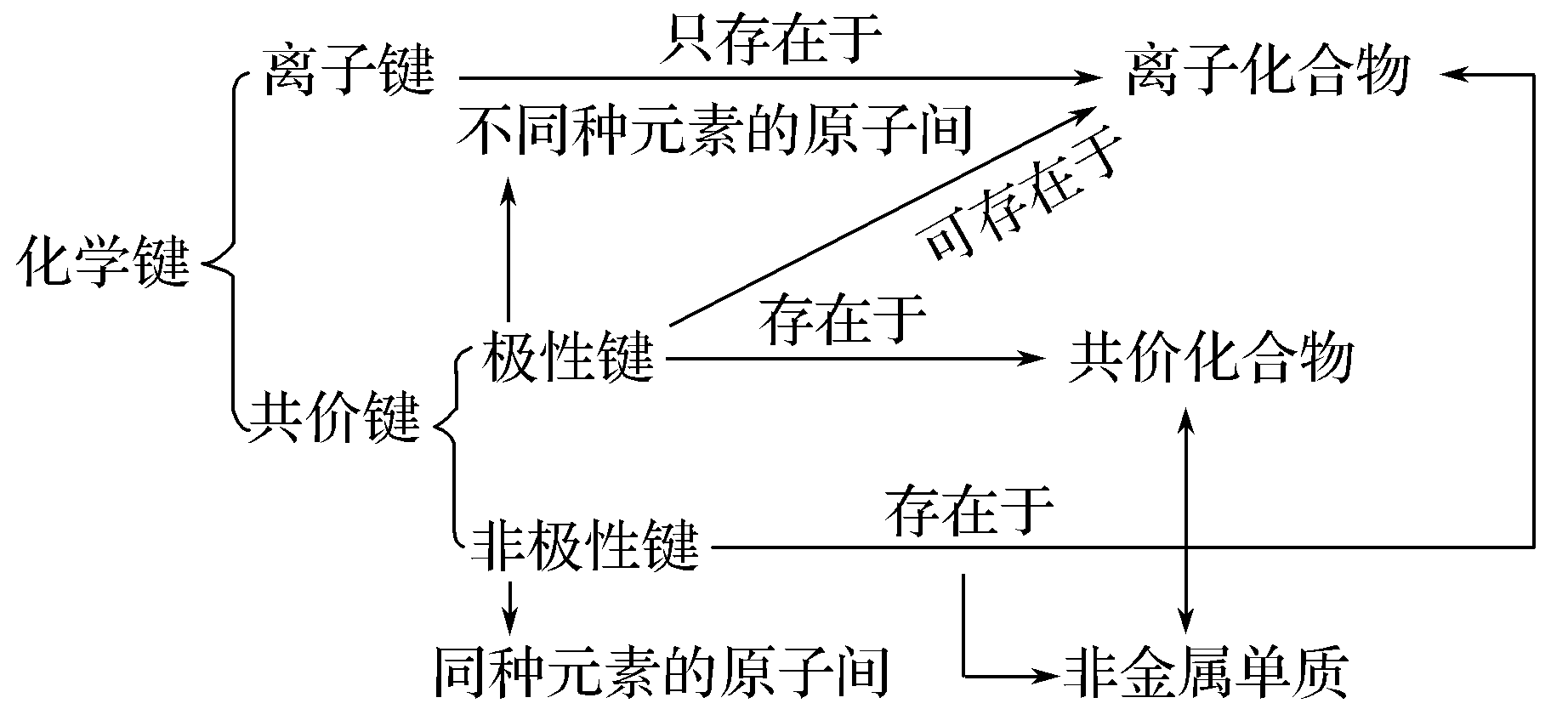
3.总结:化学键与物质类别的关系
状元体会
化学键与物质类别的关系是高考常考点,除了根据该化合物中含有化学键的特点进行判断外,还需注意以下问题:①根据熔融状态下的导电性判断化合物类型:熔融状态下能导电的化合物是离子化合物,如NaCl;熔融状态下不能导电的化合物是共价化合物,如HCl。
②在离子化合物中一般既含有金属元素又含有非金属元素(铵盐除外);共价化合物一般只含有非金属元素,但个别含有金属元素,如AlCl3也是共价化合物;只含有非金属元素的化合物不一定是共价化合物,如铵盐。
③非金属单质只有共价键(稀有气体除外)。
④气态氢化物是共价化合物,只含共价键,而金属氢化物(如NaH)是离子化合物,含离子键。
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
- 上一篇:三维设计高考复习课件试题学案资料包第五…
- 下一篇:元素周期表、元素周期律知识精华
相关文章
-
没有相关内容


 会员登录
会员登录