《几种重要的金属化合物》典例精析二
1.下列说法不正确的是( )
A.Na2O2可用于呼吸面具中氧气的来源
B.Na2O和Na2O2投入水中都能生成NaOH,都是氧化还原反应,它们都是碱性氧化物
C.Na2CO3可用于制玻璃、肥皂、造纸、纺织等工业,而NaHCO3可用于治疗胃酸过多,制造发酵粉等
D.NaCl的性质稳定,可用作调味品
【解析】反应Na2O+H2O=2NaOH,不是氧化还原反应,Na2O是碱性氧化物.反应2Na2O2+2H2O=4NaOH+O2↑是氧化还原反应,但Na2O2不是碱性氧化物.
【答案】B
2.为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,则该样品的纯度(质量分数)是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
【解析】设样品中含NaHCO3 x g。

【答案】A
3.下列有关焰色反应叙述正确的是( )
A.氯化钾在火焰上灼烧时使火焰呈黄色
B.焰色反应是金属单质的特性
C.连续做两个样品时,应将铂丝用硫酸洗净并灼烧到无特殊焰色
D.可用洁净的铁丝代替铂丝进行焰色反应
【解析】焰色反应是某些金属元素的特性,不论该金属元素是游离态还是化合态,在火焰上灼烧时产生的焰色是相同的;在连续做多个样品时每次都要用稀盐酸洗涤并灼烧到无特殊焰色时为止,才能做下一个样品;由于铁在灼烧时没有特殊的焰色,所以能用它代替铂进行实验,其他还有镍(Ni)也能替代铂进行实验.
【答案】D
4.下列叙述中正确的是( )
A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成
B.向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1∶2
C.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D.向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出
【解析】A项,CaCO3+CO2+H2O=Ca(HCO3)2,产物与NaHCO3不反应。B项,发生反应:![]() ,不生成CO2。C项,等质量的NaHCO3和Na2CO3分别与足量盐酸反应时,NaHCO3产生的CO2多.D项,向饱和Na2CO3溶液中通入CO2时发生反应:Na2CO3+CO2+H2O=2NaHCO3↓,反应中消耗H2O,且生成的NaHCO3溶解度小、质量多,故NaHCO3会结晶析出。
,不生成CO2。C项,等质量的NaHCO3和Na2CO3分别与足量盐酸反应时,NaHCO3产生的CO2多.D项,向饱和Na2CO3溶液中通入CO2时发生反应:Na2CO3+CO2+H2O=2NaHCO3↓,反应中消耗H2O,且生成的NaHCO3溶解度小、质量多,故NaHCO3会结晶析出。
【答案】D
5.下列氧化物中,既能溶于强酸,又能溶于强碱的是( )
A.Fe2O3 B.Ag2O C.CuO D.Al2O3
【解析】A、B、C中的氧化物都是碱性氧化物,而氧化铝是两性氧化物,即氧化铝既能与强酸反应生成盐和水,又能与强碱反应生成盐和水。
【答案】D
6.将NaOH溶液逐滴加入用盐酸酸化了的AlCl3溶液中,若用y轴表示Al(OH)3沉淀量,x轴表示NaOH溶液的体积,下列图像正确的是( )
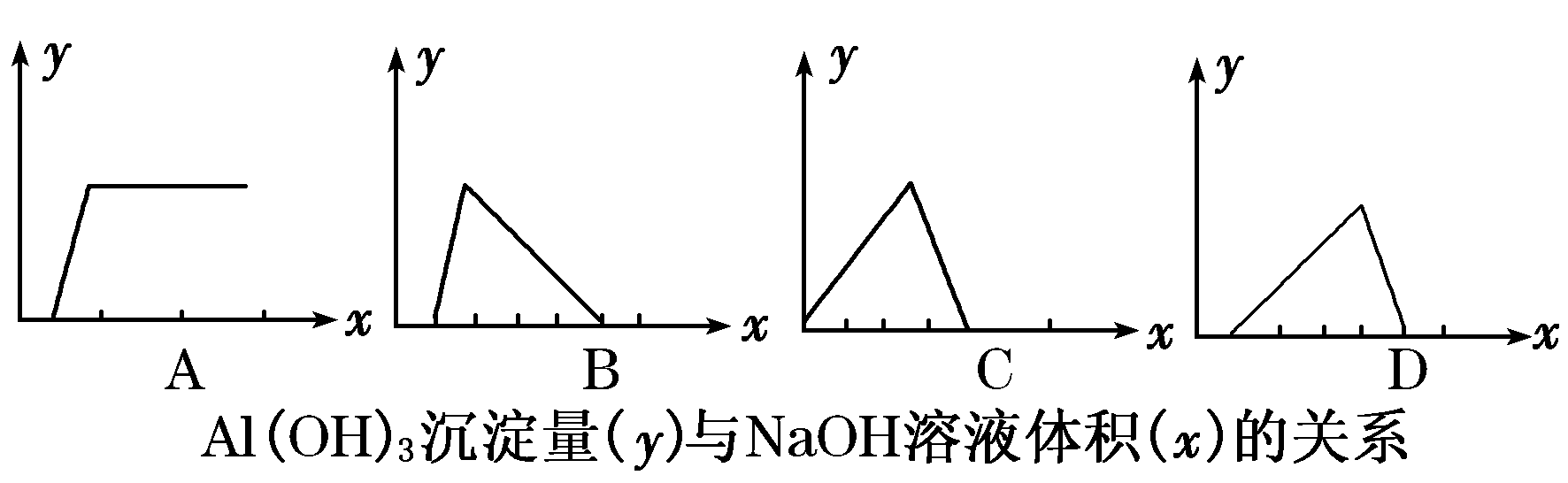
【解析】当溶液中既有H+,又有Al3+时,加入OH-则先与H+反应,而后才与Al3+发生反应.所以在生成沉淀前加入的NaOH与H+反应,无沉淀生成。
【答案】D
7.将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中铝元素的质量与溶液中所含铝元素的质量相等,则原氯化铝溶液和氢氧化钠溶液的物质的量浓度之比可能是( )
A.1∶3 B.2∶3 C.1∶4 D.7∶2
【解析】本题应对两种情况进行讨论:
①若AlCl3过量,NaOH量不足,溶液中铝元素应为Al3+。
AlCl3+3NaOH=Al(OH)3↓+3NaCl
1 mol 3 mol 1 mol
依题意,溶液中剩余1 mol Al3+,
c(AlCl3)∶c(NaOH)=n(AlCl3)∶n(NaOH)
=(1+1) mol∶3 mol=2∶3。
②若NaOH量稍多,AlCl3完全反应,生成的Al(OH)3部分溶解,溶液中铝元素的存在形式为![]() ,不妨假设有2 mol Al3+反应,依题意有关系式:
,不妨假设有2 mol Al3+反应,依题意有关系式:
AlCl3 ~ 3NaOH ~ Al(OH)3
1 mol 3 mol 1 mol
AlCl3 ~ 4NaOH ~ NaAlO2
1 mol 4 mol 1 mol
则c(AlCl3)∶c(NaOH)=n(AlCl3)∶n(NaOH)
=(1+1) mol∶(3 mol+4 mol)=2∶7。
【答案】B
8.A、B、C是单质,其中A是金属,各种物质间的转化关系如图:
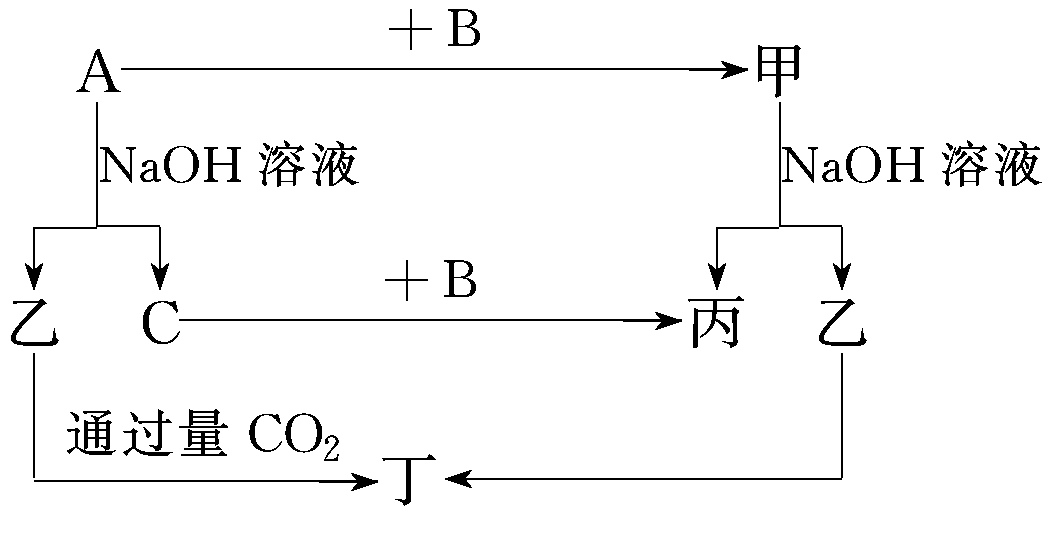
根据图示转化关系回答:
(1)写出下列物质的化学式。
A ,B ,
乙 ,丁 。
(2)写出下列变化的化学方程式。
①A与NaOH溶液反应的化学方程式
。
②甲与NaOH溶液反应的离子方程式
。
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36 L,则消耗的A的物质的量为 ,转移电子的物质的量为 。
【解析】常见金属单质中能与NaOH溶液反应产生气体的只有Al,所以A是Al,乙是NaAlO2,C是H2,甲是Al的化合物,可和NaOH溶液反应产生NaAlO2,可能是Al2O3,则丙是H2O,B即是O2,根据NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3↓得丁是Al(OH)3。
【答案】(1)Al O2 NaAlO2 Al(OH)3
(2)①2Al+2NaOH+2H2O=2NaAlO2+3H2↑
②![]()
(3)0.1 mol 0.3 mol
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
相关文章
-
没有相关内容


 会员登录
会员登录