《生活中常见的盐》典例精析二
【例1】氯化钠溶液中溶有少量碳酸钠,下列物质中可用来除去Na2CO3的是( )
A.Zn粉 B.Ca(OH)2 溶液 C.盐酸 D.硫酸
【分析】除杂质采用化学方法时,可将杂质转化为气体或沉淀或水而除去,也可将之转化为所要保留的那种物质,转化时应注意不能引入新的杂质。A中锌粉与碳酸钠不反应,故不选用。B中Na2CO3+Ca(OH)2=2NaOH+CaCO3↓,虽除去了Na2CO3,但同时又产生新杂质NaOH,故不选用。C中Na2CO3+2HCl=2NaCl+H2O+CO2↑,可以除去Na2CO3。D中H2SO4+Na2CO3 = Na2SO4+H2O+CO2↑,产生新杂质Na2SO4,不选用。
【答案】C
【点评】除杂质时应注意不能引入新的杂质,并考虑可操作性强,操作简单。
【例2】A、B、C、D分别是盐酸、Na2CO3、CaCl2、AgNO3、HCl 四种溶液中的一种。将它们两两混合后,观察到的现象如下表1所示(“↓”表示沉淀;“↑”表示气体;“-”表示不反应)。请据此回答:
(1)A、B、C、D溶液中溶质的名称或化学式:
A.__________________B.________________C._____________D.________________
(2)C和D反应的化学方程式为______________________________________
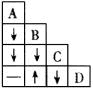
表1【分析 】本题主要考查物质之间的关系以及产生的现象等知识。根据给定的四种物质间的相互关系,可得出表2。
CaCl2 | Na2CO3 | AgNO3 | HCl | |
CaCl2 | - | ↓ | ↓ | - |
Na2CO3 | ↓ | - | ↓ | ↑ |
AgNO3 | ↓ | ↓ | - | ↓ |
HCl | - | ↑ | ↓ | - |
由表1可知,A所给信息最多,对照表2,可知A为CaCl2,与之无明显现象的是HCl,则D为HCl;B与D有气体产生,B为Na2CO3,故C为AgNO3。
【答案】(1)A-CaCl2 B- Na2CO3 C-AgNO3 D-HCl
(2)AgNO3 + HCl=AgCl↓+HNO3
【点评】根据题中给予的信息认真分析各物质性质及可能性去推断,且书写化学方程式要配平。
【例3】某溶液中仅含有AgNO3和Cu(NO3)2两种溶质,将其分为A、B两份,各加入一定量的Fe粉,充分反应后,过滤洗涤,分别得到滤渣和滤液。
(1)将A得到的滤渣加入到稀盐酸中有气泡产生,则该滤渣中含有的物质是________(填化学式)。
(2)往B得到的滤液中滴稀HCl,有白色沉淀生成,则对应的滤渣中含有________,滤液中含有的溶质是________。
【分析】A所得到的滤渣加入稀盐酸有气泡产生,证明Fe过量,则AgNO3和Cu(NO3)2必然完全反应。因Fe过量,滤渣中有:Fe、Cu、Ag,有关反应有Fe+ 2AgNO3= Fe(NO3)2 +2Ag,Fe+ Cu(NO3)2=Fe(NO3)2+Cu;B所得滤液中加入稀HCl,有白色沉淀生成,证明滤液中有AgNO3,说明Fe粉量不足,仅与部分AgNO3反应。由于Cu比Ag活泼,故Fe先与AgNO3反应,待AgNO3没有了,Fe才会与Cu(NO3)2反应。还有AgNO3时,Cu(NO3)2一定存在。
【答案】(1)Fe、Cu、Ag (2)Ag AgNO3,Cu(NO3)2,Fe(NO3)2
【点评】认识金属活泼顺序及盐之间的反应规律,再考虑反应物中的过量物从而分析题。
【例4】La(镧)是一种活动性比锌强的元素,其氧化物为La2O3,对应的碱La(OH)3难溶于水,而LaCl3、La(NO3)3都易溶于水。下列物质中,不能直接反应制得LaCl3的是 ( )
A.La+HCl B.La2O3+ HCl C.La(OH)3+ HCl D.BaCl2+ La(NO3)3
【解析】本题所给信息是:La(OH)3难溶于水、LaCl3、La(NO3)3都易溶于水,根据复分解反应的条件可知:BaCl2与La(NO3)3反应的产物中没有气体、沉淀或水生成,因此反应不能发生。
【答案】D
【例5】某校初中化学课外活动兴趣小组的学生,将一些可溶性化合物溶于水,配成甲、乙两瓶溶液,共含有H+、K+、Ag+、Ba2+、OH-、Cl-、CO32-、NO3-八种离子,每瓶溶液里含有的四种离子各不相同。已知向甲瓶溶液中滴入紫色石蕊试液后,溶液变成蓝色,据此推知乙瓶溶液中的离子应该是____________(填离子符号)
【解析】甲瓶溶液使紫色石蕊试液变成蓝色,说明甲溶液显碱性,肯定含有OH-;则与之不能大量共存的H+肯定在乙溶液中;与H+不能大量共存的CO32-肯定在甲溶液中;与CO32-不能大量共存的Ag+、Ba2+肯定在乙溶液中;与Ag+不能共存的Cl-肯定在甲溶液中,则NO3-属于乙溶液。因此乙瓶溶液中的离子应该是:H+、Ag+、Ba2+、NO3-。
【答案】乙瓶溶液中的离子应该是:H+、Ag+、Ba2+、NO3-。
【例6】如图所示,甲、乙两个相邻的工厂向河水中排放的废水中分别含有CuSO4、NaOH、BaCl2、FeCl3四种物质中的两种。某中学环保小组对河水取样测试时发现A处河水的pH>7。试回答:
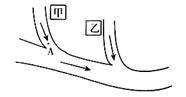
(1)乙工厂排放的废水中,含有的两物质是______________。
(2)请你从环境保护的角度出发,给甲、乙两厂提出合理化建议:__________________。
【解析】本题是一道以化工生产中的废水为载体的考查复分解反应的习题,主要考查酸、碱、盐的溶液间相互反应的知识。
【答案】(1)A处河水的pH>7,说明甲工厂排放的废水中含有NaOH,NaOH与CuSO4、FeCl3两溶液不能共存,因此,乙工厂排放的废水中含有的两物质是CuSO4、FeCl3。
(2)为了保护环境,使两厂排放的废水不污染环境,建议:两场建立废水处理厂,将两厂废水按一定比例混合、沉淀,再经过必要的工艺处理后排放;甲、乙两厂分别用必要的试剂和工艺对废水进行净化处理后再排放。
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
- 上一篇:《生活中常见的盐》典例精析一
- 下一篇:九年级化学精编导学练11.1.1《氯化钠》
相关文章
-
没有相关内容


 会员登录
会员登录