《分子晶体与原子晶体》知识全解
课标要求
1.了解分子晶体与原子晶体的组成粒子及粒子间的作用力。
2.了解分子晶体的结构特征及性质的一般特点。
3.理解范德华力与氢键两种常见分子间作用力对分子晶体性质的影响,能描述干冰及冰的结构特点及差异。
4.了解金刚石等原子晶体的结构特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。
5.了解晶体类型与性质的关系,能区分原子晶体与分子晶体。
重难点突破
教学重点:
1.分子晶体、原子晶体的概念;
2.晶体类型与性质之间的关系;
3.氢键对物质物理性质的影响。
教学难点:
1.分子晶体、原子晶体的结构特点;
2.氢键对冰晶体结构和性质的影响。
突破方法:
1.运用晶体的晶胞类型和数据资料,回忆已学过的知识,解释晶体性质的根源。
2.运用归纳、演绎和对比等方法,理解分子晶体、原子晶体的各自特点及其之间的联系与区别。
3.查阅相关资料,以数据说明分子晶体和原子晶体的物质的物理性质的不同,结合教材内容,从结构决定性质的角度出发,探讨分子晶体和原子晶体物理性质的不同。
4.通过展示分子晶体(如干冰)和原子晶体(如金刚石)的结构模型或通过学习小组利用球棍模型或其他物品制作简易的自制模型,从不同视角认真对比原子晶体和分子晶体在晶体结构上的不同点。
教法建议
判断哪些晶体是分子晶体,哪些晶体是原子晶体,可以结合元素周期表的内容,找出易形成分子晶体或原子晶体的元素在元素周期表中的大致位置。
如何理解氢键对分子晶体结构的影响是本节的难点,可以利用物理现象(如冰浮于水面而干冰沉于水中)和物理性质(如冰、干冰和水的密度),使学生对冰和干冰的物理性质上的差异有所认识,并结合氢键和分子间作用力的区别尝试进行解释。干冰和冰的晶体结构特点是分子晶体结构中的普遍性和特殊性,由于冰中氢键的方向性决定了冰晶体的结构特点有其特殊性。氢键的作用力大于分子间的范德华力,所以冰和干冰的性质存在差异。
对于原子晶体的教学,可要求学生注意从分子晶体和原子晶体的不同点加以分析,可以利用金刚石的多媒体课件或立体模型,组织学生认识原子晶体与分子晶体的区别。
学法建议
认真阅读教材相关内容,并仔细观察分子晶体和原子晶体的结构模型(球棍模型或多媒体展示模型),并查阅大量的分子晶体和原子晶体的相关数据,对比、分析、归纳得出分子晶体和原子晶体的特点。
知识集合
(一)分子晶体
1.概念
只含分子的晶体称为分子晶体。
2.结构特点
(1)分子晶体中存在的粒子:分子。
(2)粒子间的作用力
①分子内原子间以共价键相结合。
②若分子间作用力只是范德华力,由于范德华力不具有方向性,因此分子晶体有分子密堆积特征,即通常每个分子周围有12个紧邻的分子。
例如:干冰晶体
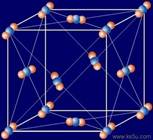
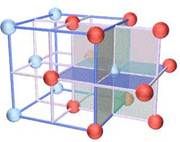
干冰结构模型 每个分子周围有12个紧邻的分子
a.干冰在常压下极易升华
b.干冰中的CO2分子间只存在范德华力而不存在氢键,一个CO2分子周围等距紧邻的CO2分子有12个。
③若分子间含有其它作用力,如氢键,则每个分子周围紧邻的分子数要少于12个。
例如:冰
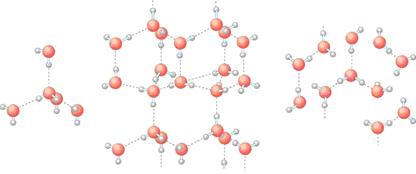
冰的结构模型,每个水分子周围只有4个紧邻的分子
a.冰晶体中水分子间的主要作用力是氢键,当然也存在范德华力。
b.氢键有方向性,它的存在迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子互相吸引。
3.分子晶体种类
(1)所有非金属氢化物,如:H2O、H2S、NH3、HCl、CH4等。
(2)部分非金属单质,如:红磷、白磷(P4)、卤素单质(X2)、硫单质(S8)、碳60(C60)等。
(3)部分非金属氧化物,如:CO2、SO2、P4O6、P4O10等。
(4)几乎所有的酸,如:HNO3、H2SO4等。
(5)绝大多数有机物的晶体,如:乙酸、苯等。
4.分子晶体的物理性质及熔沸点变化规律
(1)由于分子晶体是通过分子间作用力结合构成的,分子间作用力较弱,故分子晶体的熔、沸点较低,硬度较小。
(2)熔沸点变化规律
①对组成和结构相似、晶体中不含氢键的物质来说,随着相对分子质量的增大,分子间作用力增强,熔沸点升高。如:卤素单质,四卤化碳,稀有气体等。
②有机物中,同分异构体支链数越多,熔沸点越低。
③如果分子间存在氢键,则其沸点要高于组成和结构相似的没有氢键的分子晶体,如沸点:H2O>H2S;HF>HCl;NH3>PH3。
(二)原子晶体
1.概念
相邻原子间以共价键相互结合形成的具有三维的共价键网状结构的晶体,叫原子晶体,又叫共价晶体。
2.结构特点
(1)原子晶体的基本粒子:原子。
(2)形成原子晶体的作用力:共价键。
3.典型的原子晶体
(1)金刚石
①在晶体中每个碳原子以四个共价键与相邻的4个碳原子相结合。
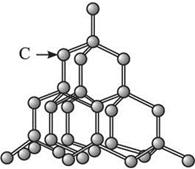
金刚石的晶体结构模型
②晶体中C-C-C夹角为109°28′,碳原子采取了sp3杂化。
③最小环上有六个碳原子。
④晶体中碳原子个数与C-C键数之比为1:(4×![]() )=1:2
)=1:2
(2)二氧化硅
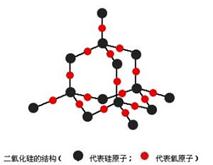
二氧化硅晶体结构模型
4.原子晶体的种类
(1)某些非金属单质,如:金刚石、晶体硅、晶体硼等。
(2)某些非金属化合物,如:碳化硅(SiC)、氮化硅(Si3N4)等。
(3)某些氧化物,如:二氧化硅(SiO2)、刚玉(Al2O3晶体)等。
(4)其他,如:氮化铝(AlN)等。
5.原子晶体的物理性质及变化规律
(1)结构特点
原子晶体是原子间以共价键结合而成的空间网状结构,晶体中不存在单个分子。
(2)物理性质特点
①因为原子晶体中原子间以较强的共价键相结合,熔化时需要很多的能量克服共价键,所以原子晶体的熔、沸点很高,硬度很大,没有延展性。
②因为构成原子晶体的原子最外层电子都已成键,结构稳定,键能较大,所以原子晶体一般不导电,难溶于水。
(3)物理性质的变化规律
在结构相似的情况下,原子半径越小,键长越短,键能越大,晶体的熔点就越高,硬度越大。
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
- 上一篇:没有了!
- 下一篇:选修3名校试题精编精析3.2《分子晶体与原…
相关文章
-
没有相关内容


 会员登录
会员登录