《原子结构与元素的性质》知识全解
课标要求
1.认识原子结构与元素周期系的关系,了解元素周期系的应用价值。
2.掌握元素周期律中半径的变化规律。
3.能说出元素的电离能、电负性的涵义,能应用元素的电离能和电负性说明元素的性质。
4.进一步形成有关物质结构的基本观念,初步认识物质的结构与性质之间的关系。
5.从科学家探索物质构成奥秘的史实中体会科学探究的过程和方法,在抽象思维、理论分析的过程中逐步形成科学的价值观。
重难点突破
本节课的教学重点:
1.元素的原子结构与元素周期表结构的关系;
2.电离能、电负性与元素性质的关系;
3.原子半径、第一电离能、电负性的周期性变化。
教学难点:
1.元素周期表的分区;
2.电离能、电负性的概念及应用;
突破方法:
1.由浅入深,由旧知识引入,循序渐进,引导学生从更高层面理解原子结构与元素周期律的关系;
2.将复杂的概念如电离能、电负性,简单化,通俗化,找出与类似知识点的相同点,理解记忆;
3.充分利用数据,教会学生用数据、图表等客观地分析问题,找出规律,深刻理解用定量的方式解决抽象的概念。
教法建议
本节内容与必修2的元素周期律的内容有一定相似,但实质上难度明显不同,可以以问问题思考的形式复习原子结构、元素周期律和元素周期表的相关知识,逐渐引导学生从元素原子核外电子排布特征的角度进一步认识、理解原子结构与元素在周期表中位置的关系。
对于电离能和电负性概念的教学,应通过大量数据和客观事实,突出电离能、电负性与元素性质间的关系。在理解电离能概念和要点的基础上,重点引导学生认识、理解元素电离能与元素性质间的关系。对于电负性的教学,可以通过引导学生对教材中图1-23所列元素的电负性数据与元素性质间规律的探究,使学生清楚地认识到电负性与金属性非金属性强弱的关系。
学法建议
学生在学习本节内容时,注意结合已有知识点,在理解原子结构与元素周期表时,充分利用新学的构造原理,特别是认识元素周期表的分区;进行适当地小组讨论交流,总结归纳出元素原子的外围电子排布的特征与元素周期表结构的关系,元素原子的核外电子排布与元素在元素周期表中位置、元素性质三者之间的关系。
在元素周期律的理解上,先从已知的核电荷数、核外电子排布、化合价、金属性与非金属性的周期性变化上,再借助于数据和图标探索规律的思想,总结归纳出电离能(主要指第一电离能)、电负性发生周期性变化的规律。
知识集合
一、原子结构与元素周期表
1.原子的电子构型与周期的关系
(1)每周期第一种元素的最外层电子的排布式为ns1,每周期结尾元素的最外层电子排布式除He为1s2外,其余为ns2np6(He核外只有2个电子,只有1个s轨道,还未出现p轨道,所以第一周期结尾元素的电子排布跟其他周期不同)。由此可见,元素周期系的形成是由于元素的原子核外电子的排布发生周期性的重复。
(2)一个能级组最多所容纳的电子数等于一个周期所包含的元素种类。但一个能级组不一定全部是能量相同的能级,而是能量相近的能级。
2.元素周期表的分区
(1)根据核外电子排布
①分区
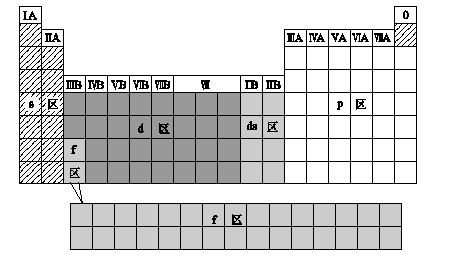
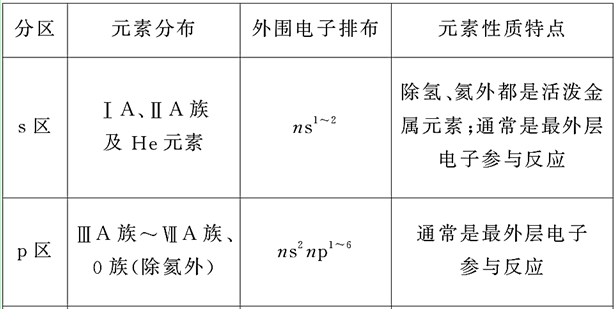
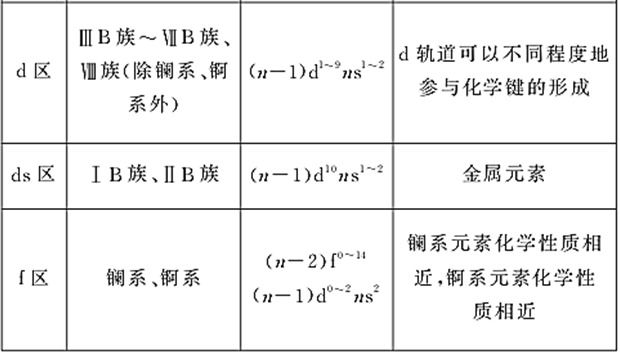
②各区元素化学性质及原子最外层电子排布特点
③若已知元素的外围电子排布,可直接判断该元素在周期表中的位置。如:某元素的外围电子排布为4s24p4,由此可知,该元素位于p区,为第四周期ⅥA族元素,即最大能层为其周期数,最外层电子数为其族序数,但应注意过渡元素(副族与第Ⅷ族)的最大能层为其周期数,外围电子数应为其纵列数而不是其族序数(镧系、锕系除外)。
二、元素周期律
1.电离能、电负性
(1)电离能:是指气态原子或离子失去电子时所需要的最低能量。
①第一电离能是指电中性基态原子失去1个电子转化为气态基态正离子所需要的最低能量。第一电离能数值越小,原子越容易失去1个电子。
②在同一周期的元素中,碱金属(或第ⅠA族)第一电离能最小,稀有气体(或0族)第一电离能最大,从左到右总体呈现增大趋势。同主族元素,从上到下,第一电离能逐渐减小。同一原子的第二电离能比第一电离能要大
③电离能的应用
电离能用来衡量失去电子的难易,比较金属的活动性和元素的金属性。一般,第一电离能越小,金属性越强。如碱金属的第一电离能越小,碱金属越活泼。
(2)元素的电负性用来描述不同元素的原子对键合电子吸引力的大小。以氟的电负性为4.0,锂的电负性为1.0作为相对标准,得出了各元素的电负性。
①电负性的大小也可以作为判断金属性和非金属性强弱的尺度,金属的电负性一般小于1.8,非金属的电负性一般大于1.8,而位于非金属三角区边界的“类金属”的电负性在1.8左右。它们既有金属性,又有非金属性。
②电负性的应用
a.判断元素的金属性和非金属性及其强弱
b.金属的电负性一般小于1.8,非金属的电负性一般大于1.8,而位于非金属三角区边界的“类
c.金属(如锗、锑等)的电负性则在1.8左右,它们既有金属性,又有非金属性。
d.金属元素的电负性越小,金属元素越活泼;非金属元素的电负性越大,非金属元素越活泼。
e.同周期自左到右,电负性逐渐增大,同主族自上而下,电负性逐渐减小。
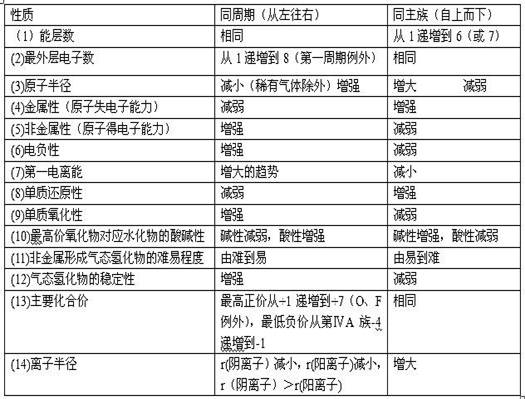
2.原子结构与元素性质的递变规律
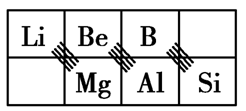
3.对角线规则
在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的,如
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
- 上一篇:没有了!
- 下一篇:选修3名校试题精编精析1.2《原子结构与元…
相关文章
-
没有相关内容


 会员登录
会员登录