《原子结构》知识全解
课标要求
1.进一步认识原子核外电子的分层排布,知道原子核外电子的能层、能级分布及其能量关系,能用符号表示原子核外的不同能级,初步知道量子数的涵义。
2.了解原子结构的构造原理,能用构造原理认识原子的核外电子排布,能用电子排布式表示常见元素(1~36号)原子核外电子的排布
3.了解能量最低原理,知道基态与激发态,知道原子核外电子在一定条件下会发生跃迁产生原子光谱。
4.了解原子核外电子的运动状态,知道电子云和原子轨道。
5.了解泡利原理和洪特规则。
重难点突破
教学重点:
1.根据构造原理写出1~36号元素原子的电子排布式;
2.核外电子的运动状态,电子云与原子轨道;
3.泡利原理、洪特规则。
教学难点:
1.电子云与原子轨道;
2.基态、激发态与光谱。
突破方法:
1.通过化学史引入,由浅入深,循序渐进;
2.充分利用多媒体课件,高科技图片,展示微观世界;
3.给学生提供更多的思考、探究的机会。
5.培养学生的抽象思维能力、想象力和分析能力。
教法建议
充分利用课本教材,结合章图,可以课前安排学生收集有关原子结构理论发展史的材料,上课时组织学生交流讨论。通过复习学生已有的知识,逐步深入,层层递进,从原子的基本结构,到核外电子分层排布,进一步认识到核外电子按照能量的不同分成不同的能层和能级,接着认识原子的构造原理,指导学生逐渐学会应用构造原理写出原子的电子排布式,但不要求学生深究构造原理中能级次序的原因。有条件的学校可以借助多媒体手段,运用电脑模拟或制作原子轨道模型等手段,尽可能形象化地帮助学生理解电子云和原子轨道的概念。通过活动使学生了解原子结构中各理论的要点和相关科学家的重要贡献,体会人类对原子结构的认知是一个逐步深入的过程,科学理论的发展是一个逐步完善的过程,使学生感悟科学家献身科学的无畏精神以及进行科学探索中的不懈追求和科学严谨的态度,同时通过本课题学习增强学生对微观世界好奇心和求知欲,体验从探究中获得成功的喜悦,激发学习化学的兴趣。
学法建议
原子属于微观粒子,既看不见也摸不到,只能靠分析宏观现象去诱发想像而获得知识,因此,原子结构这一部分的内容对于学生的抽象思维和空间想象能力要求是较高的,大部分学生在学习这部分内容会感觉比较吃力,这属于正常现象,不必太过惊慌。学生应充分发挥自身的主观能动性,课前积极预习,查阅相关资料,在课堂老师教学过程中,借助直观的多媒体课件和一些关于微观粒子运动变化的动画或图片,把抽象变为生动,增强学习这部分知识的兴趣,对于一些比较深奥的知识点,按照大纲要求,简单了解即可,避免过度探究。通过相应练习和反馈,熟练掌握和学会应用本课的重点知识。
知识集合
1.能层与能极
(1)概念
能层:在多电子的原子核外电子的能量是不同的,按电子的能量差异,可以将核外电子分成不同的能层。
能级:在多电子的原子中,同一能层的电子,能量也可能不同,还可以把它们分成能级。
(2)不同能层、能级可容纳的电子数
能层(n) | 一 | 二 | 三 | 四 | 五 | 六 | 七 | |||||||
符号 | K | L |
| M | N | O | P | Q | ||||||
能级(l) | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | … |
| … |
最多电子数 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | … | … | … |
2 | 8 | 18 | 32 | … | … | 2n2 | ||||||||
(3)能层与能级有关规律
①每个能层中,能级符号的顺序是:ns、np、nd、nf…(n代表能层)
②任一能层的能级总是从s开始,而且能级数等于该能层序数:第一能层只有1个能级(1s),第二个能层有2个能级(2s和2p),第三个能层有3个能级(3s、3p、3d),依次类推。
③以s、p、d、f…排序的各能级可容纳的最多电子数依次是1、3、5、7的2倍…
2.原子轨道

3.原子核外电子排布规律
(1)构造原理
多电子原子的核外电子排布式总是按照能量最低原理,由低能级逐步填充到高能级。随着核电荷数递增,大多数元素的电中性基态原子的电子按右图顺序填入核外电子运动轨道(能级),这种排布顺序被称为构造原理。
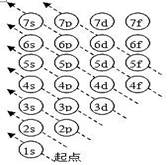
能级交错:由构造原理可知,从第三能层开始各能级不完全遵循能层顺序而产生了能级交错排列,例如,电子先进入4s轨道,后进入3d轨道,这种现象叫能级交错。
(2)能量最低原理
现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。
构造原理和能量最低原理是从整体角度考虑原子的能量高低,而不局限于某个能级。
(3)泡利(不相容)原理:基态多电子原子中,不可能同时存在4个量子数完全相同的电子。即,一个原子轨道里最多只能容纳两个电子,且两个电子的自旋方向相反(用“↑↓”表示),这个原理称为泡利(Pauli)原理。
(4)洪特规则:当电子排布在同一能级的不同轨道(能量相同)时,总是优先单独占据一个轨道,而且自旋方向相同,这个规则叫洪特(Hund)规则。比如,p3的轨道式为![]() 或
或
![]() ,而不是
,而不是![]() 。
。
洪特规则特例:当p、d、f轨道填充的电子数为全空(p0、d0、f0)、半充满(p3、d5、f7)或全充满(p6、d10、f14)时,体系的能量较低,原子处于较稳定的状态。
前36号元素中,
全空状态的有:4Be:2s22p0、12Mg:3s23p0、20Ca:3d04s2;
半充满状态的有:7N:2s22p3、15P:3s23p3、24Cr:3d54s1、25Mn:3d54s2、33As:4s24p3;
全充满状态的有:10Ne:2s22p6、18Ar:3s23p6、29Cu:3d104s1、30Zn:3d104s2、36Kr:4s24p6。
4.基态原子核外电子排布的表示方法
(1)电子排布式
①用数字在能级符号的右上角表明该能级上排布的电子数,这就是电子排布式。
例如K:1s22s22p63s23p64s1。
②为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体元素原子结构的部分以相应稀有气体的元素符号外加方括号表示,例如K:[Ar]4s1。
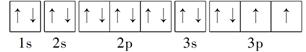
(2)电子排布图(轨道表示式)
每个方框或圆圈代表一个原子轨道,每个箭头代表一个电子。
如,基态硫原子的轨道表示式为
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
- 上一篇:没有了!
- 下一篇:元素周期表的衍变
相关文章
-
没有相关内容


 会员登录
会员登录