《空气》知识全解
课标要求
1.了解空气的主要成分和含量。
2.通过对“测定空气里氧气含量”实验的操作、观察和分析,初步学习简单的实验设计、观察实验现象并加以描述,对相关实验现象能给出合理的解释。
3.初步学会认识纯净物和混合物的概念。
4.初步了解有关氧气、氮气和稀有气体的一些物理性质和主要用途。
5.知道空气是一种宝贵自然资源,初步了解空气污染的危害,养成关注环境、热爱自然的情感。
知识结构

重难点突破
“测定空气里氧气含量”、纯净物和混合物是本课题的重难点,对此分别可通过实验探究的方式和习题练习进行突破。
(一)测定空气里氧气含量
过程如下:演示测定空气中氧气含量的实验,介绍仪器名称、装置原理、操作顺序和注意事项。边做实验边提出观察的注意点,并提出问题让学生思考。
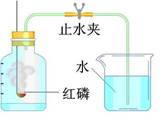
测定空气里氧气的含量
(1)盛放红磷的集气瓶内,除了水,还有什么?
(2)将红磷点燃后放到集气瓶里,见到什么现象?
(3)红磷熄灭冷却后把弹簧夹打开后会有什么现象?为什么?
(4)该反应的实验原理是什么?
(5)通过该实验得出的结论是什么?
实验结束后,提出下列问题让学生讨论思考5分钟后回答。
(1)集气瓶内水的作用是什么?
(2)燃烧匙内放过量红磷的目的是什么?
(3)为什么实验开始前要关闭弹簧夹?如未关闭,可能的后果是什么?
(4)为什么要等集气瓶冷却后才能打开弹簧夹?
(5)如果装置的气密性不好,结果可能是什么?
(6)若剩余气体是氮气,且氮气是“不能维持生命”的气体,同学们可以用什么假设来说明呢?上述实验不仅知道N2不能维持生命,还可以知道N2的什么性质?
(7)红磷熄灭后瓶内还有没有残余的氧气?
(8)在实验中,为什么气体减少的体积小于1/5?可能的原因有哪些?
讨论发言:能够说明空气确实存在的实验或实例。学生互相评价。
观察实验后回答:
(1)空气;
(2)产生大量白烟;
(3)水进入集气瓶约1/5体积,因为红磷燃烧消耗了瓶内的氧气,且生成物是固体,导致集气瓶内的气压减小,因而水倒流;
(4)原理:磷+氧气![]() 五氧化二磷
五氧化二磷
P+O2![]() P2O5
P2O5
(5)结论:氧气约占空气体积的1/5体积。
学生讨论思考5分钟后回答。
(1)一是防止热的生成物溅落炸裂瓶底;二是为了吸收生成的白烟。P2O5易溶于水,可以使实验现象更接近理论值。
(2)使瓶内的氧气全部参加反应。
(3)防止瓶内的空气受热膨胀后逸出,使测定结果偏大。
(4)因为燃烧放热,瓶内温度较高气体气压较大,引起测量结果偏低。
(5)燃烧结束时瓶内压强减小,瓶外的空气会进入集气瓶,引起测量结果偏低。
(6)可以在剩余气体中放一只飞虫,飞虫不久会死亡。难溶于水、不能燃烧也不支持燃烧。
(7)有;红磷在氧气含量过低的实验条件下不能继续燃烧。
(8)①装置漏气;②红磷量不足;③装置未冷却就打开弹簧夹。
(二)纯净物和混合物
学完纯净物和混合物的概念后,教师可出示下列练习当堂训练。
氮气、二氧化碳、红磷、空气、河水、矿泉水等物质,哪些是混合物,哪些是纯净物?并由学生判断。
练完后,教师趁热打铁归纳混合物和纯净物的区别:是否由一种物质组成,是否有固定的组成和性质。并指出混合物中各成分之间没有发生化学反应,都保持各自的化学性质。再次强化学生对纯净物和混合物的了解。
教法建议
本节课中由于学生没有学习压强,根据学生已有的经验在教学中应充分增设实验(胶头滴管吸液体、吸管喝牛奶等实验),加深学生对压强知识的了解,从而降低学生理解空气中氧气含量测定原理的难度。另外,还应因材施教,联系当地学生的实验,举一些学生常见的例子区分纯净物和混合物,让学生头脑中初步形成“物质观”,为以后学习奠定坚实的基础。
学法建议
对于空气中氧气含量测定的实验原理,我们可采用联系生活中的自行车轮胎爆炸,分析影响气体压强的因素,然后总结气体压强与气体多少、温度等因素有关。学习纯净物和混合物时,应用列表比较法,对它们的不同之处一一比较进行比较,加深对纯净物和混合物的理解。
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
- 上一篇:九年级化学高效课时通练习2.1《空气》pdf
- 下一篇:《空气》典例精析一
相关文章
-
没有相关内容


 会员登录
会员登录