巧用“质量守恒定律”解题

质量守恒定律是自然界中一切化学反应都必须遵守的一条定律。从宏观看,在化学反应前后物质的总质量保持不变;从微观看,在化学反应前后原子的种类和数目保持不变。初中阶段,该定律的应用主要有以下几个方面:
(1)确定物质的化学式
例:已知化学反应A2+3B2=2C,则C的化学式为 (用A、B表示)。
解析:根据质量守恒定律,在化学反应前后A、B原子的种类和数目不变,反应前A原子总数为2,B原子总数为6,故C的化学式为AB3。
(2)确定物质的相对分子质量
例:在2A+3B=C+4D反应中,已知34 g A与20 g B恰好完全反应,生成12 g C。若A的相对分子质量为136,则D物质的相对分子质量为多少?
解析:根据质量守恒定律,求出生成物D的质量,再通过化学方程式中A与D的质量比与相对分子质量的关系求解。
设D物质的相对分子质量为x。
则:2A + 3B = C + 4D
2×136 4x
34 g 34 g+20 g-12 g
![]()
x=84
答:D物质的相对分子质量为84。
(3)求反应中某物质的质量
例:已知反应3A+2B=2C+D,若A、B两物质完全反应时质量比为3∶4,生成C和D的质量之和为140 g,则该反应消耗B的质量为________。
解析:根据质量守恒定律,反应前后物质的总质量保持不变,有m(A)+m(B)=m(C)+m(D),则参加反应的A和B的质量之和为140 g,所以消耗B的质量为140 g×4/7=80 g。
(4)确定物质的组成
例:将1.8 g某可燃物在氧气中充分燃烧,生成4.4 g二氧化碳和3.6 g水。据此推断该可燃物一定由哪些元素组成?
分析:根据质量守恒定律,参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。生成CO2中的碳元素、水中的氢元素一定来自该可燃物。通过4.4 g CO2与3.6 gH2O可算出碳元素与氢元素的质量总和,若质量总和等于1.8 g,原可燃物是由碳氢两种元素组成;若质量总和小于1.8 g,二者相差的质量一定是原可燃物中的氧元素的质量,则原可燃物一定由碳、氢、氧三种元素组成。
解:4.4 g CO2中含碳元素的质量为
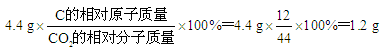
3.6 gH2O中含氢元素的质量为
![]()
碳、氢两种元素的质量总和为1.2 g+0.4 g=1.6 g。
因为1.6 g小于原可燃物1.8 g,所以原可燃我种一定含有氧元素。
答:该可燃物一定由碳、氢、氧三种元素组成。
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
- 上一篇:罗蒙诺索夫
- 下一篇:九年级化学上册pdf教案5.1《质量守恒定律》
相关文章
-
没有相关内容


 会员登录
会员登录