《甲烷 烷烃》典例精析二
1.能够证明甲烷分子的空间结构为正四面体的事实是( )
A.甲烷的4个碳氢键的键能相等
B.甲烷的4个碳氢键的键长相等
C.甲烷的一氯代物只有1种
D.甲烷的二氯代物只有1种
【解析】先把CH4分子空间构型的几种可能性画出来,然后依次思考排列可得到答案。
【答案】D
2.在集气瓶内使甲烷与氧气混合,点燃,进行爆炸性实验,下列甲烷与氧气的体积比(同温、同压)中,爆炸声最大的是( )
A.1∶1 B.1∶2 C.1∶3 D.3∶1
【解析】爆炸声最大的必要条件之一:气体恰好完全反应,使单位体积的气体反应放出的热量最多。甲烷与氧气在点燃的条件下发生完全反应的化学方程式为CH4+2O2CO2+2H2O。符合此反应中CH4与O2的物质的量比即可。
【答案】B
3.下列分子具有正四面体结构的是( )
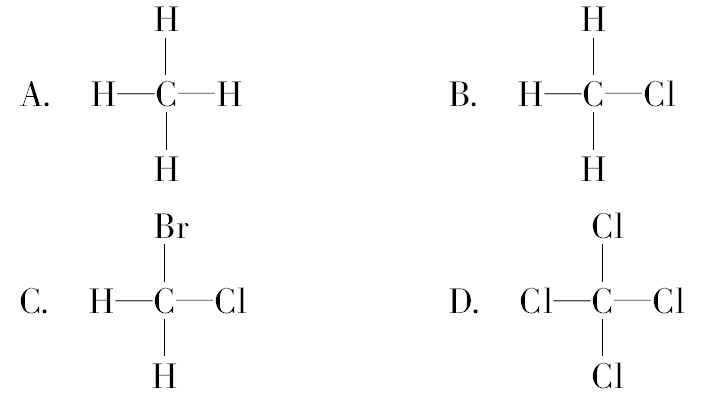
【解析】本题主要考查甲烷分子的正四面体结构。由甲烷分子的结构,推导其取代物的分子结构。同时应明确正面体结构中各键应完全一样。CH4为正四面体结构,若CH4分子中4个氢原子被氯原子取代后,与CH4分子结构相似,而CHCl3、CH2BrCl分子中各键不完全相同,均不属于正四面体结构。
【答案】A、D
4.某无色混合气体可能由CH4、NH3、H2、CO、CO2和HCl中的某几种气体组成。在恒温恒压条件下,将此混合气体通过浓H2SO4时,总体积基本不变;通入过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使CuSO4粉末变色。则原混合气体的成分是( )
A.CH4和NH3 B.HCl、H2和CO
C.HCl和CO D.HCl、CO和CO2
【解析】混合气体通过浓H2SO4时总体积基本不变,说明没有NH3,排除了A项。混合气体通入过量的澄清石灰水未见变浑浊,但混合气体的总体积减小,说明没有CO2、有HCl;剩余气体导出后,在O2中能够点燃,燃烧产物不能使CuSO4粉末变色,说明没有氢元素,排除了B、D。
【答案】C
5.下列说法正确的是( )
A.凡是分子组成相差一个或几个CH2原子团的物质,彼此一定是同系物
B.相对分子质量相同的几种化合物,就称为同分异构体
C.组成元素的质量分数相同,且相对分子质量也相同的不同化合物,互为同分异构体
D.凡是符合通式CnH2n+2的化合物,一定是烷烃
【解析】同系物的概念中,首先是结构相似为前提,缺少这一条件时,就不一定是同系物了,所以A不正确。同分异构体的前提是分子式相同,虽然同分异构体的相对分子质量一定相同,这还是因为它们的分子式相同的缘故;但相对分子质量相同的化合物其分子式不一定相同,如H2SO4和H3PO4、C2H6和CH2O,因此相对分子质量相同的化合物不一定就是同分异构体,故B也不正确。组成元素的质量分数相同,且相对分子质量也相同,说明它们的分子式一定相同,既然是不同的化合物,结构肯定不同,它们之间是同分异构体是确定无疑的,C正确。由于烷烃结构的特点,碳原子的价键被氢原子所饱和,氢原子的数目已达最大比例,所以只要符合通式CnH2n+2的烃,一定是烷烃,故D也是正确的。
【答案】C、D
6.下列说法正确的是( )
A.分子组成相差1个或若干个CH2原子团的物质互称为同系物
B.相对分子质量相同的有机物是同分异构体
C.碳原子之间只以单键相结合的链烃为烷烃
D.分子式相同,结构相同的有机物一定是同一种物质
【解析】同系物必须是结构相似,在分子组成上相差一个或若干个CH2原子团的物质。结构相似即强调必须是同一类有机物之间,才能互称同系物。所以A不正确。相对分子质量相同的有机物不一定存在同分异构关系,如C10H8与C9H20的相对分子质量都是128,显然它们之间无同分异构关系。所以化合物之间要存在有同分异构关系,就必须具有相同的分子式。
【答案】C、D
7.在下列结构的有机化合物中,属于同分异构体的正确组合是( )
①CH3CH2CH2CH2CH3
②CH3CH2CH2CH2CH2CH3
③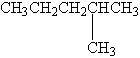
④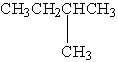
⑤
A.①和③ B.②③⑤ C.①和② D.③和④
【解析】根据同分异构体的特点:分子式相同,结构不同,首先找出具有相同碳原子数的有机物,①和④都有5个碳原子,②③⑤都是6个碳原子,然后再看它们的结构,都是烷烃,但是结构不同,所以①和④互为同分异构体,②③⑤互为同分异构体。
【答案】B
8.下列五种烃:①2-甲基丁烷、②2,2-二甲基丙烷、③戊烷、④丙烷、⑤丁烷,按它们的沸点由高到低的顺序排列正确的是( )
A.①>②>③>④>⑤ B.②>③>⑤>④>①
C.③>①>②>⑤>④ D.④>⑤>②>①>③
【解析】掌握烷烃同系物的物理性质的递变规律是解答本题的关键。同类烃碳原子数越多,熔沸点越高;同类烃中碳原子数相同时,支链越多,其熔沸点越低。故它们的沸点顺序排列为:戊烷>2-甲基丁烷>2,2-二甲基丙烷>丁烷>丙烷。
【答案】C
9.燃烧0.1 mol两种气态烃的混合物,生成3.58 L CO2(标准状况)和3.60 g H2O,则混合气体中( )
A.一定有甲烷 B.一定有乙烷
C.一定无甲烷 D.一定有丙烷
【解析】生成![]() ,生成
,生成![]() ,因此两种气态烃的平均组成为C1.6H4,根据混合物的平均组成可知,碳原子组成小于1.6的烃只有甲烷,而另一种烃氢原子数必为4,碳原子数大于或等于2的气态烃。因此只有选项A正确。
,因此两种气态烃的平均组成为C1.6H4,根据混合物的平均组成可知,碳原子组成小于1.6的烃只有甲烷,而另一种烃氢原子数必为4,碳原子数大于或等于2的气态烃。因此只有选项A正确。
【答案】A
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
- 上一篇:《甲烷 烷烃》典例精析一
- 下一篇:全国化学优质课上课教案:陈风雷《最简单…
相关文章
-
没有相关内容


 会员登录
会员登录