中学化学中反常规情况的归纳与分析
掌握规律是人们认识事物的重要手段。中学化学中有许多规律,但没有物理中的定律、数学中的定理那样严密,往往有一些反常的特例,学习过程中容易被疏忽。因此,在学习中要掌握物质的个性,并处理好共性和个性的关系,全面运用知识去认识问题。下面就中学化学中常见的反常规情况进行讨论。
在复分解反应的规律中,一般只能由强酸制弱酸。
但向CuCl2溶液中滴加氢硫酸可制盐酸:CuCl2+H2S===CuS↓+2HCl,此反应为弱酸制强酸的反常情况。其原因是Ksp很小的CuS难溶于强酸中。
反应3NaI+H3PO4(浓)===Na3PO4+3HI↑可以发生,是因为符合高沸点酸制备低沸点酸的规律。 本文来自中学化学同步辅导!
另外,H2SO3可被HNO3、HClO等溶液氧化为H2SO4。
3H2SO3+2HNO3===2NO↑+3H2SO4+H2O;H2SO3+HClO===HCl+H2SO4 本文来自中学化学同步辅导!
2.弱碱能制强碱。 本文来自中学化学同步辅导!
典型反应:①AgOH+2NH3·H2O===[Ag(NH3)]2OH+2H2O 本文来自中学化学同步辅导!
②Ca(OH)2+Na2CO3===CaCO3↓+2NaOH 本文来自中学化学同步辅导!
反应①属于络合反应,反应能发生的原因是Ag+与NH3的络合能力较强。 本文来自中学化学同步辅导!
反应②属于复分解反应,反应能发生的原因是生成不溶于水的CaCO3沉淀。 本文来自中学化学同步辅导!
3.碱与碱也可反应。 本文来自中学化学同步辅导!
一般情况下,碱与碱不反应,但一些难溶性碱由于发生络合反应却能溶解在弱碱氨水中。如Cu(OH)2+4NH3·H2O===[Cu(NH3)4](OH)2+4H2O等。
4.酸与酸也可反应。 本文来自中学化学同步辅导!
5.酸性氧化物与酸也能反应。
6.还原性弱的物质可制还原性强的物质。
氧化还原反应中氧化性还原性的强弱比较的基本规律如下:
氧化性强弱为:氧化剂>氧化产物,还原性强弱为:还原剂>还原产物
但工业制硅反应中,还原性弱的碳能制还原性强的硅,原因是上述规则只适用于溶液中,而此反应为高温下的气相反应。又如钾的还原性比钠强,铷的还原性比钙强,但工业上可用Na制K,用Ca制Rb,原因是K的沸点比Na低,Rb的沸点比Ca低,可以控制反应温度使K、Rb为蒸气而逸出,使生成物浓度减小,反应向正方向进行。
7.金属活动顺序表中氢后面的金属也能置换酸中氢。 本文来自中学化学同步辅导!
一般只有氢前面的金属才能置换出酸或水中的氢。但Hg和Ag能发生如下反应:Hg+ H2S===HgS+H2↑;2Ag +H2S===Ag2S+H2↑。原因是HgS和Ag2S溶解度极小,有利于化学反应向正方向移动。
8.元素的金属性或非金属性较强,其单质不活泼。
一般情况下,元素的金属性或非金属性较强,其单质也越活泼。但对于少数元素的原子及其单质活泼性则表现出不匹配的关系。如金属性铅比锡强,但金属活动顺序表中锡在铅的前面。原因是比较的条件不同,前者指气态原子失电子时铅比锡容易,而后者则是指在溶液中单质锡比单质铅失电子容易;O的非金属性比Cl强,但O2分子比Cl2分子稳定,N的非金属性比P强,但N2比磷单质稳定得多,N2甚至可代替稀有气体作用,原因是单质分子中化学键结合程度影响分子的性质。 本文来自中学化学同步辅导!
9.溶液中活泼的金属或非金属单质不能置换不活泼的金属或非金属。
一般情况下,在溶液中活泼金属或非金属单质能置换不活泼金属或非金属。但Na、K等非常活泼的金属却不能把相对不活泼的金属从其盐溶液中置换出来;F2不能把Cl、Br、I从其盐溶液中置换出来。原因是在水溶液中离子和水形成水合离子完全被水分子包围,非常活泼的单质先与溶剂水发生置换反应。 本文来自中学化学同步辅导!
10.S较O2易与Hg、Ag反应。
一般为氧化性或还原性越强,反应越强烈,条件越容易。O2、S分别与金属反应时,一般O2更容易些。但它们与Hg、Ag反应时,硫在常温下就能与Hg、Ag发生反应。 本文来自中学化学同步辅导!
11.氧的非金属性较强,但自然界中却可以游离态存在。
12.氧气比硫活泼,但是钠在氧气中能安静的燃烧,而与硫混合研磨却爆炸。钠在氧气中燃烧放出热量容易散失,硫与钠混合研磨放热不易散失,故而爆炸。
13.空气中氮气和氧气的体积比约为4:1,但是镁带在空气中燃烧主要生成氧化镁而不是氮化镁。
反应的方向不是看反应物的量,而是取决于反应物的性质。由于氧气比氮气活泼,所以主产物是氧化镁而不是氮化镁。
14.Ca比Na活泼,但是与水反应Na却比Ca剧烈。
Ca与水反应生成微溶于水的Ca(OH)2覆盖在Ca的表面,降低了化学反应速率。
15.金刚石和石墨均含碳碳共价键,但是石墨的熔点却比金刚石高。
尽管金刚石和石墨均有碳碳共价键,但是石墨除了碳碳单键外,每一个碳原子将多余的一个自由电子与其他碳原子形成大的离域π键。
本文来自中学化学同步辅导!
16.复分解反应的条件是有难溶物或气体或弱电解质生成,但是侯式制碱法中却生成了可溶于水的小苏打。
小苏打尽管可以溶于水,但溶解度较小,在饱和的氯化钠溶液中通入氨气和二氧化碳条件下,相当于是不溶物。这符合离子反应规律。
17.增大反应物的浓度,其转化率反而增大。
增大反应物A的浓度,那么A的转化率一般降低,但是对于反应:2NO2(气)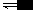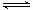 N2O4(气)当它在固定容积的密闭容器中反应时,若增大NO2的浓度时,因体系内压强增大,从而时平衡向着气体体积减小的方向移动,即平衡向右移动。此时NO2的转化率不是减小,而是增大了。
N2O4(气)当它在固定容积的密闭容器中反应时,若增大NO2的浓度时,因体系内压强增大,从而时平衡向着气体体积减小的方向移动,即平衡向右移动。此时NO2的转化率不是减小,而是增大了。
18.酸酐不是氧化物。 本文来自中学化学同步辅导!
酸酐一般是氧化物,但是有机酸的酸酐往往不是氧化物。
19.可以用CaCO3与稀硫酸或浓盐酸反应制取CO2。
在初三特别强调不能用二者与CaCO3制取二氧化碳,究其原因,是碳酸钙与稀硫酸反应时有微溶于水的CaSO4生成,覆盖在CaCO3表面,从而阻止了反应的进一步发生;而不用浓盐酸的原因是浓盐酸易挥发,使生成的二氧化碳中混有杂质HCl。但是如果我们将碳酸钙研成粉末的话,反应就能很顺利地发生。同理,我们也可以将用浓盐酸与碳酸钙制得的二氧化碳气体通过一个盛有饱和NaHCO3的洗气瓶,这样既可除去杂质氯化氢,而二氧化碳也不会溶解。
20.有单质参与或生成的反应不是氧化还原反应。
比如同素异形体之间的转变。因为互为同素异形体的物质的结构不同,它们之间的转变有化学键的断裂与形成。
21.SO2能漂白常见的有机色素及一些指示剂,但不能漂白石蕊试液,而只能将石蕊试液变红。
22.卤素及其化合物有关特性。 本文来自中学化学同步辅导!
卤素单质与水反应通式为:X2+H2O==HX+HXO,而F2与水的反应放出O2;其它卤化银难溶于水且有感光性,而AgF溶于水无感光性;其它卤化钙易溶于水,而CaF2难溶于水;F没有正价而不能形成含氧酸;含有同种元素不同价态的不同物质,一般为价态越高氧化性越强,但氯的各含氧酸却是价态越低氧化性越强。
本文来自中学化学同步辅导!
23.硅的反常性质。
硅在常温下很稳定,但自然界中没有游离态的硅而只有化合态,原因是硅以化合态存在更稳定;一般只有氢前面活泼金属才能置换酸或水中的氢,但非金属硅却与强碱溶液反应产生H2。原因是硅表现出一定的金属性,在碱作用下还原水电离的H+而生成H2;非金属一般不能置换酸中的氢,但硅能置换氢氟酸中的氢;硅的还原性比碳强,而碳在高温下却能从二氧化硅中还原出硅;酸酐一般均能与水反应生成相应的酸,二氧化硅是硅酸的酸酐,但不能与水反应生成硅酸,一般用可溶性硅酸盐跟酸作用来制备;非金属氧化物一般是分子晶体,而二氧化硅却是原子晶体;无机酸一般易溶于水,而硅酸和原硅酸却难溶于水;碳酸的酸性比硅酸强,但反应SiO2+Na2CO3 Na2SiO3+CO2↑也能进行,因为该反应不是在水溶液中进行的;硅酸盐的水溶液俗称水玻璃,但它和玻璃的化学成分并不相同;硅酸钠的水溶液也叫泡花碱,但硅酸钠是盐而不是碱。
Na2SiO3+CO2↑也能进行,因为该反应不是在水溶液中进行的;硅酸盐的水溶液俗称水玻璃,但它和玻璃的化学成分并不相同;硅酸钠的水溶液也叫泡花碱,但硅酸钠是盐而不是碱。
24.铁、铝与浓硫酸、浓硝酸发生钝化。
常温下,铁、铝分别与稀硫酸和稀硝酸反应,而浓硫酸或浓硝酸却能使铁铝钝化,原因是浓硫酸、浓硝酸具有强氧化性,使它们表面生成了一层致密的氧化膜。 本文来自中学化学同步辅导!
25.气体分子数不相等的可逆反应改变压强平衡不移动。
对于反应体系中有气体参与的可逆反应,改变压强,平衡移动应符合勒夏特列原理。例如,对于气体分子数不相等的反应达到平衡后,在恒温恒容下充入稀有气体时,压强增大,但平衡不移动,因为稀有气体不参与反应,各物质的平衡浓度并没有改变。
26.强碱弱酸盐溶液显酸性。
盐类水解后溶液的酸碱性判断方法为:谁弱谁水解,谁强显谁性,强碱弱酸盐水解后一般显碱性。但NaHSO3和NaH2PO4溶液却显酸性,原因是它们的电离程度均大于它们的水解程度。
27.较不活泼的金属或非金属原电池的负极。
本文来自中学化学同步辅导!
28.有机物中不饱和键难加成。
有机物中若含有不饱和键,如>C=O时,可以发生加成反应,但酯类或羧酸中的>C=O,一般很稳定而难加成。
29.稀有气体也可以发生化学反应。 本文来自中学化学同步辅导!
稀有气体结构稳定,性质极不活泼,但在特殊条件下也能发生化学反应,目前世界上已合成多种含稀有气体元素的化合物。如XeF2、XeF4等。
本文来自中学化学同步辅导!
30.1H的原子核只有一个质子。
31.物质的物理性质反常。
(1)物质熔点反常:VA主族的元素中,从上至下,单质的熔点有升高的趋势,但铋的熔点比锑低; IVA主族的元素中,锡铅的熔点反常;常温下三种物质(汞、钾钠合金、水)的状态反常。过渡元素金属单质通常熔点较高,而Hg在常温下是液态,是所有金属中熔点最低的。合金通常为固态,而钾钠合金为液态。非金属氢化物通常为气态,而氧的氢化物即水却为液态。氢化物熔点反常。对于结构相似,相对分子质量越大,熔、沸点越高,但在同系列氢化物中HF、H2O、NH3熔、沸点反常,原因是它们易形成氢键。
(2)沸点反常:IVA主族元素中,硅、锗沸点反常;VA主族元素中,锑、铋沸点反常。 本文来自中学化学同步辅导!
(3)密度反常:碱金属单质从上至下密度有增大的趋势,但钾反常;碳族元素单质中,金刚石和晶体硅密度反常。
(4)导电性反常:一般非金属导电性差,但石墨是良导体,C60可做超导材料。
(5)物质溶解度有反常:相同温度下,一般正盐的溶解度小于其对应的酸式盐。但Na2CO3溶解度大于NaHCO3;若温度改变时,溶解度一般随温度的升高而增大,但Ca(OH)2的溶解度随温度的升高而减小。
32.化学实验中反常规情况。
使用试纸时,一般要用水润湿,但使用pH试纸则不能用水润湿,因为润湿过程会稀释溶液,影响溶液pH值的测定。
胶头滴管操作应将它垂直于试管口上方1~2cm处,否则容易弄脏滴管而污染试剂。但向FeSO4溶液中滴加NaOH溶液制备Fe(OH)2时,为了防止带入O2而使生成的Fe(OH)2氧化成Fe(OH)3,滴管不仅要伸入到试管中,而且还要将滴管下端口插入到液面以下。
使用温度计时,温度计一般应插入液面以下,但蒸馏时,温度计不插入液面下而应在支管口附近,以便测量馏分温度。
取用化学试剂时,多余的试剂
在中学化学的学习实践中,我们对一些规律早已耳熟能详,但是我们也遇到了一些和这些规律截然不同的“反常现象”,这给同学们的学习带来了一定的思维阻碍,只要我们仔细分析,掌握其本质,就可以轻松地掌握这些反常的特殊规律,完善自已的知识系统。
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
相关文章
-
没有相关内容


 会员登录
会员登录