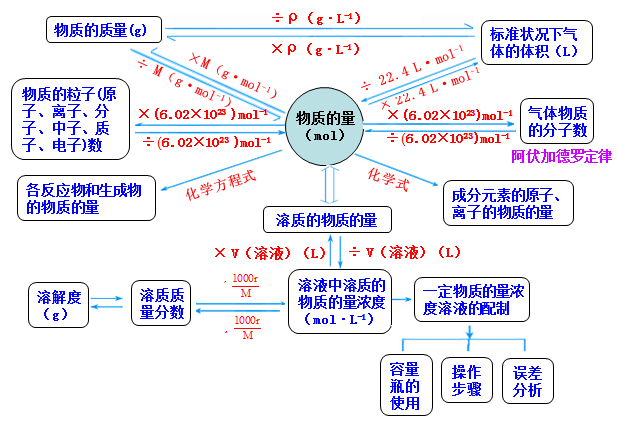
物质的量基础知识梳理
 本文来自中学化学同步辅导!
本文来自中学化学同步辅导!
一、基本概念辨识
1.物质的量
(1)概念:表示物质所含微粒数目多少的物理量
(2)符号:n
(3)单位:mol
2.摩尔
(1)概念:摩尔是物质的量的单位,每1mol物质含有阿伏加德罗常数个结构微粒。 本文来自中学化学同步辅导!
(2)符号:mol
(3)说明:①当描述物质的物质的量(使用摩尔)时,必须指明物质微粒的名称,不能是宏观物质名称;②常见的微观粒子有:分子、原子、离子、电子、质子、中子或它们特定的组合;③当有些物质的微观粒子只有一种时,可以省略其名称。
3.阿伏加德罗常数
(1)含义:实验测定12g12C中碳原子的个数
(2)符号:NA
(3)单位:个/mol
(4)说明:①NA的基准是12g碳-12中的原子个数;②12C不仅是摩尔的基准对象,而且还是相对原子质量的基准;③NA是一个实验值,现阶段常取6.02×1023作计算;④要注意NA与6.02×1023的区别。
4.摩尔质量
(1)概念:单位物质的量的物质的质量
(2)符号:![]()
(3)单位:g·mol-1
(4)说明:①注意与化学式的式量相比较,区分其中的差异。②化学计算题中常会用平均摩尔质量,注意跟平均相对分子质量的差异。③与1mol物质的质量的比较。 本文来自中学化学同步辅导!
5.气体摩尔体积
(1)概念:单位物质的量的气体的体积
(2)符号:![]() 本文来自中学化学同步辅导!
本文来自中学化学同步辅导!
(3)单位:L·mol-1
(4)标准状况下的气体摩尔体积:①标准状况:0℃、1atm即1.01×105Pa;②理想气体。③标准状况下的气体摩尔体积约为22.4L·mol-1。
(5)影响物质体积大小的因素:
①构成物质的微粒的大小(物质的本性)
②结构微粒之间距离的大小(温度与压强来共同决定)
③结构微粒的多少(物质的量的大小)
6.物质的量浓度
(1)概念:用单位体积的溶液中溶解溶质的物质的量的多少来表示溶液的浓度 本文来自中学化学同步辅导!
(2)符号:![]()
(3)单位:mol·L-1
(4)说明:①物质的量浓度是溶液的体积浓度。②溶液中的溶质既可以为纯净物又可以为混合物,还可以是指某种离子或分子。 本文来自中学化学同步辅导!
二、常用计算公式和注意问题 本文来自中学化学同步辅导!
1.m、n、N之间的计算关系 本文来自中学化学同步辅导!
(1)计算关系:![]() =
=![]()
(2)使用范围:只要物质的组成不变,无论是何状态都可以使用
2.V、n、N之间的计算关系 本文来自中学化学同步辅导!
(1)计算关系:![]() =
=![]() =
=![]()
(2)使用范围:①适用于所有的气体,无论是纯净气体还是混合气体
②当气体摩尔体积用22.4L·mol-1时必须是标准状况
3.c、m、V、N之间的计算关系
(1)计算关系:![]()
(2)使用范围: 本文来自中学化学同步辅导!
①以上计算关系必须是在溶液中使用 本文来自中学化学同步辅导!
②微粒数目是指某种溶质
③若溶液是由气体溶解于水形成的,要特别注意以下几点:
a.必须根据定义表达式进行计算
b.氨水中的溶质主要是NH3·H2O,但要以NH3为准计算
c.不要错误的用水的体积或气体与水的体积之和当作溶液体积,必须是通过![]() 计算最后溶液的体积。 本文来自中学化学同步辅导!
计算最后溶液的体积。 本文来自中学化学同步辅导!
4.c、![]() %、ρ之间的计算关系
%、ρ之间的计算关系
(1)计算关系:![]()
(2)使用范围:同一种溶液的质量分数与物质的量浓度之间的换算
(3)推断方法:①根据物质的量浓度的定义表达式;②溶质的物质的量用![]() 计算;③注意溶液体积的单位。
计算;③注意溶液体积的单位。
5.混合气体的平均分子量的有关计算
(1)计算依据:①1mol任何物质的质量(以g为单位)在数值上与其式量相等。②1mol任何气体的体积(以L为单位)在数值上与气体摩尔体积(以L·mol-1为单位)相等。
(2)基本计算关系:M![]()
6.密度与相对密度
(1)密度
①计算表达式:![]() 本文来自中学化学同步辅导!
本文来自中学化学同步辅导!
②使用说明:
a.适用于所有的物质,不受物质状态的限制,也适用于所有的混合物
b.所有物质:![]() ,标准状况下气体
,标准状况下气体![]()
(2)相对密度
①计算表达式:![]()
②使用说明:A.相对密度是在同温同压下两种气体的密度之比;B.既可以用于纯净气体之间的计算,也可以用于混合气体之间。
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
- 上一篇:溶液稀释与浓缩的有关计算
- 下一篇:《物质的量》思维导图
相关文章
-
没有相关内容


 会员登录
会员登录