一定物质的量浓度溶液的配制知识梳理
1.主要仪器
天平、药匙、量筒、玻璃棒、烧杯、容量瓶、胶头滴管。
2.容量瓶的构造及使用
(1)容量瓶上标有温度、规格和刻度线。常用规格有50 mL、100 mL、250 mL、1 000 mL等。
(2)容量瓶在使用前要检查是否漏水,其操作顺序为装水盖塞→倒立→正立→玻璃塞旋转180°→倒立。
3.配制过程
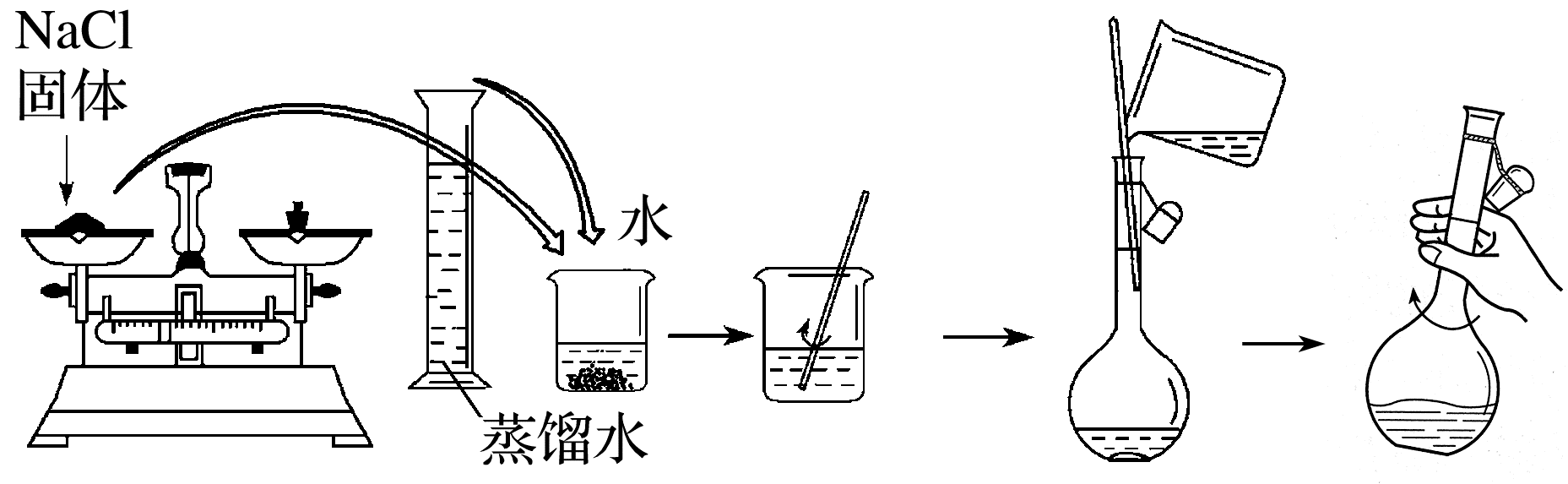
以配制100 mL 1.00 mol·L-1 NaCl溶液为例。
(1)计算:需NaCl固体的质量为5.9 g。
(2)称量:用托盘天平称量NaCl固体。
(3)溶解:将称量好的NaCl固体放入烧杯中,用适量蒸馏水溶解。
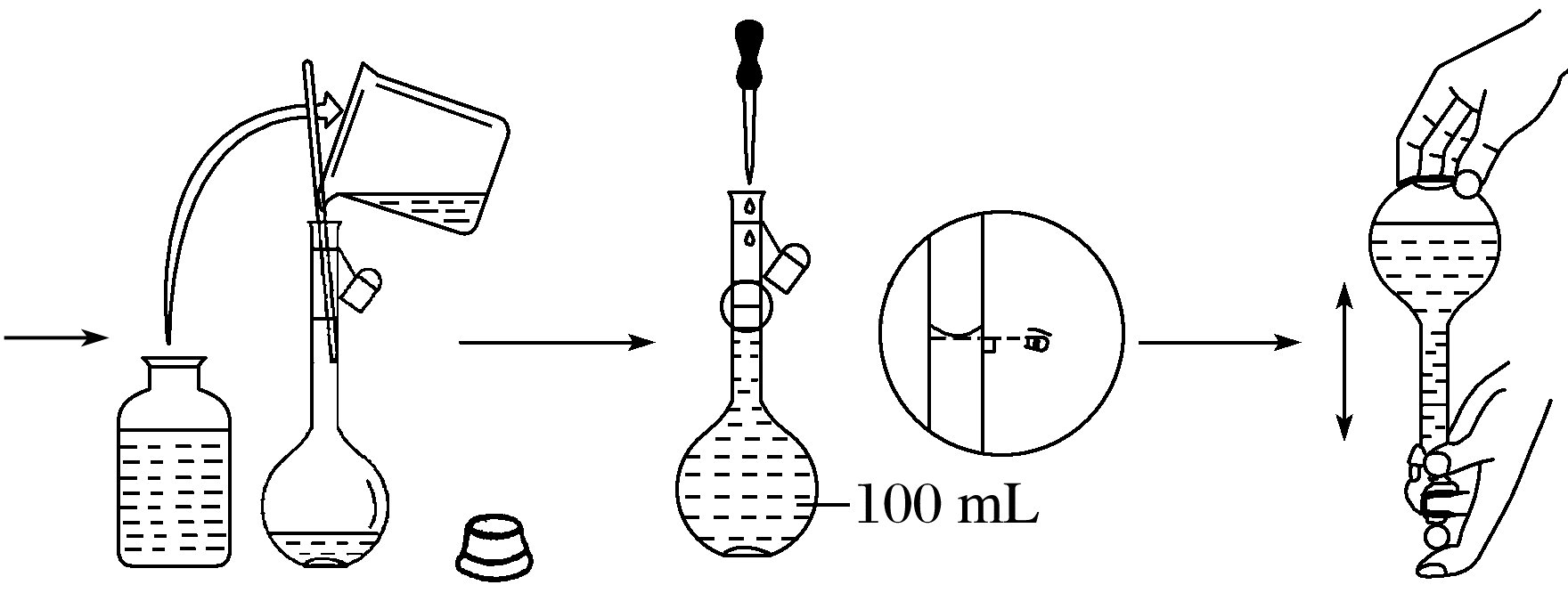
(4)移液:待烧杯中的溶液冷却至室温后,用玻璃棒引流将溶液注入100 mL容量瓶。
(5)洗涤:用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液全部注入容量瓶。轻轻摇动容量瓶,使溶液混合均匀。
(6)定容:将蒸馏水注入容量瓶,当液面距瓶颈刻度线1~2 cm时,改用胶头滴管,滴加蒸馏水至凹液面与刻度线相切。
(7)摇匀:盖好瓶塞,反复上下颠倒,摇匀。
配制流程如下图所示:
特别提醒:(回顾对比)
质量百分比浓度、体积比浓度溶液的配制
(1)配制100 g 10%的NaCl溶液。用托盘天平称取10.0 g NaCl固体,放入100 mL的烧杯中,再用100 mL量筒量取90.0 mL的水注入烧杯中,然后用玻璃棒搅拌使之溶解。
(2)用浓硫酸配制1∶4的稀硫酸50 mL。用50 mL的量筒量取40.0 mL的水注入到100 mL的烧杯中,再用10 mL 的量筒量取10.0 mL浓硫酸,然后沿烧杯内壁缓缓注入烧杯中,并用玻璃棒不停搅拌。
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
相关文章
-
没有相关内容


 会员登录
会员登录