《醛》知识全解
课标要求
1.通过乙醛掌握醛基的结构特点,理解乙醛的氧化反应和还原反应。能书写醛类的氧化和还原反应方程式。
2.理解醛类和甲醛的物理性质和用途。
3.了解银氨溶液、新制Cu(OH)2的配制方法,掌握醛基的检验方法。
重难点突破
本节课的教学重点:乙醛的结构特点和主要化学性质。突破方法是引导学生讨论乙醛的结构特点,从而推测出乙醛可能的化学性质,然后开展实验探究,验证推测结果并得出最终结论。
本节课的教学难点是:乙醛与银氨溶液、新制Cu(OH)2反应的化学方程式的正确书写。突破方法是根据乙醛与银氨溶液、新制Cu(OH)2反应的实验现象和反应规律,采取老师讲解与引导学生讨论相结合的方式,得出两个反应的化学方程式。
教法建议
先让学生复习乙醇催化氧化而生成乙醛的反应,指出其官能团是醛基,导出醛的概念,得出醛的通式,并通过多媒体展示出乙醛的分子模型。这样可以让学生了解乙醛与乙醇氧化的衍生关系,为形成“乙醇——乙醛——乙酸”知识链做准备。在讲解乙醛的化学性质时,仍然采用“结构——性质——用途”的模式,让学生从结构入手分析,推导乙醛的化学性质。醛基的氧化反应,教材中是通过乙醛与银氨溶液、新制Cu(OH)2反应来说明乙醛被氧化生成乙酸。在讲课中,让学生通过观察实验得出结论,说明氧化反应的发生。为了让学生进一步理解氧化的实质,可从结构上进行分析,醛基上的氢原子由于受C=O的影响,变得较活泼易被氧化。同时从氧化剂的强弱分析得出醛基也可以被其他的一些强氧化剂所氧化。引导学生讨论酮能否像醛一样,发生加成、氧化的反应,比较二者结构的异同,指出酮含有羰基,但羰基上并不连有H原子,再结合醛基发生加成、氧化的结构特点,不难得出酮可加成但不可进一步被氧化的结论。
学法建议
分析前面学过的乙醇的结构和断键位置,对乙醛的结构和断键位置进行分析猜想。使学生对醛基反应时断裂的化学键有初步的认识。对于乙醛的氧化反应实验,在课前应该多查阅一下相关操作的注意事项,如使用的试管要洁净,最好用新试管;硝酸银试剂要用新配制的,放置太久或酸性太强的不宜使用;控制乙醛的用量,水浴加热时不要晃动试管;最后要注意对废液进行处理等等。理解乙醛的氧化反应原理时,要尽量从基础的开始,如先从乙醛与氧气的反应开始,然后理解乙醛与新制氢氧化铜悬浊液的反应,最后再掌握乙醛与银氨溶液的反应,比较三者的异同。总之,在学习乙醛性质的过程中,一定把握好“结构决定性质”这条准则。
知识集合
1.醛类
(1)基本概念
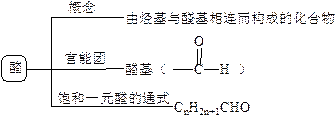
(2)甲醛、乙醛
名称 | 甲醛(蚁醛) | 乙醛 | |
分子式 | CH2O | C2H4O | |
结构简式 | HCHO | CH3CHO | |
物理性质 | 颜色 | 无色 | 无色 |
气味 | 有刺激性气味 | 有刺激性气味 | |
状态 | 气体 | 液体 | |
溶解性 | 易溶于水,35%~40%的甲醛水溶液又称为福尔马林 | 能跟水、乙醇等互溶 | |
2.乙醛的化学反应
(1)氧化反应
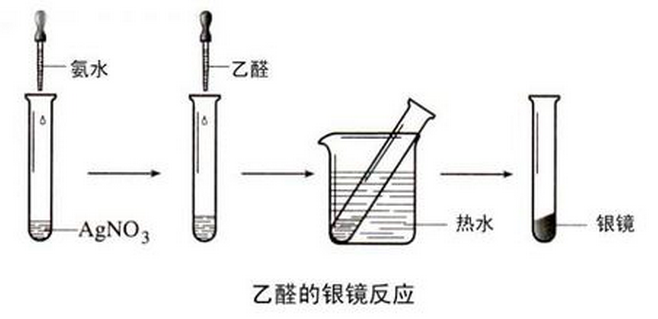
a.银镜反应
实验操作 |
|
实验现象 | 图中向试管内加入氨水的现象为先出现白色沉淀,后变澄清,水浴加热一段时间后,试管内壁出现一层光亮的银 |
有关化学方程式 |
|
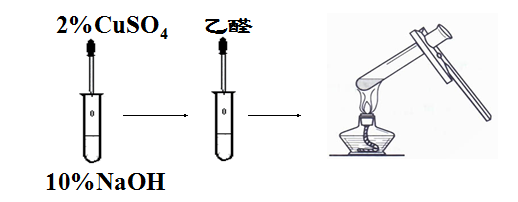
b.与新制Cu(OH)2悬浊液反应
实验操作 |
|
实验现象 | 向试管中加入硫酸铜后,出现蓝色絮状沉淀,滴入乙醛并加热至沸腾后,试管中有红色沉淀产生 |
有关化学方程式 |
|
c.催化氧化
乙醛在有催化剂并加热的条件下,能被氧气氧化为乙酸,化学方程式为:
![]()
(2)加成反应
乙醛蒸气和氢气的混合气体,通过热的镍催化剂,发生反应的化学方程式为:
![]()
3.酮
(1)基本概念

(2)丙酮
丙酮是最简单的酮类化合物,结构简式为![]() ,丙酮能与水、乙醇等混溶,它可与H2发生加成反应,但不能被银氨溶液、新制氢氧化铜悬浊液等弱氧化剂氧化。
,丙酮能与水、乙醇等混溶,它可与H2发生加成反应,但不能被银氨溶液、新制氢氧化铜悬浊液等弱氧化剂氧化。
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
相关文章
-
没有相关内容


 会员登录
会员登录