《醇 酚》知识全解
课标要求
1.认识醇、酚的典型代表物的组成、结构特点及性质,并根据典型代表物,认识醇和酚的结构特点和性质。
2.学会由事物的表象分析事物的本质、变化,进一步培养学生综合运用知识、解决问题的能力。
重难点突破
本节课的教学重点:乙醇、苯酚的结构特点和主要化学性质。突破方法是在教学过程中通过实验分别对乙醇和苯酚的化学性质进行验证,根据实验结论讨论乙醇和苯酚各自的结构特点,并通过拓展,将知识迁移到醇类和酚类的结构和性质上。
本节课的教学难点是:醇和酚结构的差别及其对化学性质的影响。突破方法是通过实验了解乙醇和苯酚的性质差别,并结合二者的结构分析产生这种差别的原因,以此拓展到其他的醇类和酚类上。
教法建议
本节研究的是醇类和酚类的性质。乙醇是生活中常见的有机物,学生们非常熟悉,由乙醇的结构和性质迁移到醇类的结构和性质,学生更容易接受。因此本节课既与前面有机物间存在相互的转化关系,也是学生掌握“类别”概念的关键,同时为以后有机合成等内容的学习打下基础,所以它在教材中处于非常重要的位置。酚类物质是采用具体代表物的方式进行学习。酚与醇结构相似,都含有羟基,本节内容是学生初次运用所学规律预测一类物质可能发生的反应,并通过各自代表物性质的对比,理解醇羟基与酚羟基的区别,体会官能团与取代基之间相互影响的重要思想,为后续有机化学的学习打下基础。另外,本节课进一步训练学生“由个别到一般”的思维方式,培养学生发现问题,学会研究的能力。因此,这节课无论在知识上,还是对学生能力的培养上,都起着十分重要的作用。
学法建议
本节内容涉及醇类与酚类的一些实验,并根据实验得出一些重要的结论。因此在学习过程中应以实验探究为主,给学生创造一个开放的环境。要求学生经历设计实验方案,实施方案及评价方案的全过程。从能力层面看,学生已经具备了一定的分析、解决问题的能力,设计分析简单实验的能力,对“结构决定性质”这一普遍规律比较熟悉,因此具有性质预测的知识基础,知道研究有机化合物的一般方法和流程,具备进行探究活动的能力。但他们自主探究的意识、合作创新的精神还有一定程度欠缺,部分学生还是习惯于做一个听众,没有从被动的学习中解放出来,学习基础较差的学生参与度不够,因此学习过程中还需要老师引导和支持。
知识集合
1.醇的概念、分类和命名
(1)概念
羟基与烃基或苯环侧链上的碳原子相连的化合物称为醇,最简单的醇是甲醇。
(2)分类
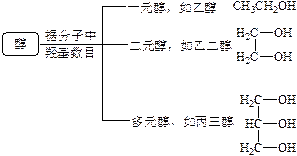
(3)醇的通式
醇的通式可由烃的通式衍变而得,如烷烃的分子通式为CnH2n+2,饱和一元醇的分子通式为CnH2n+2O(n≥1,整数),饱和一元醇的结构通式:CnH2n+1OH或简写为R—OH;饱和二元醇的分子通式为CnH2n+2O2(n≥2,整数);苯的同系物的通式为CnH2n-6,像![]() 的芳香醇的分子通式为CnH2n-6O(n≥7,整数)。
的芳香醇的分子通式为CnH2n-6O(n≥7,整数)。
(4)命名
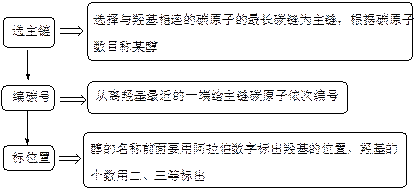
2.醇的性质
(1)物理性质
a.相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃。
b.饱和脂肪醇随分子中碳原子数目的增加,物理性质呈现规律性变化,如下表:
物理性质 | 随碳原子数增加 |
熔、沸点 | 逐渐升高,一般低级醇为液体,高级醇为固体 |
溶解性 | 一般易溶于水、有机溶剂,羟基含量越高,越易溶于水 |
密度 | 逐渐增大,但比水小 |
(2)化学性质(以乙醇为例)
a.乙醇和金属钠的反应
钠与乙醇反应,乙醇分子中的O—H键断裂,生成氢气和乙醇钠。由于烃基对羟基的影响,导致乙醇羟基中的氢原子不如水分子中的氢原子活泼,所以乙醇与钠的反应比水与钠的反应速率要缓和得多。
反应的化学方程式为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
注意:①钠原子能置换乙醇分子中羟基上的氢原子,但不能置换烃基上的氢原子。
②1 mol—OH与足量Na反应可产生0.5 mol H2。
③其他活泼金属,如K、Ca、Mg、Al等,也能与乙醇反应,放出氢气。
b.消去反应
有机化合物在适当的条件下,从一个分子中脱去一个小分子(如水、卤化氢等),而生成不饱和(含双键或三键等)化合物的反应。
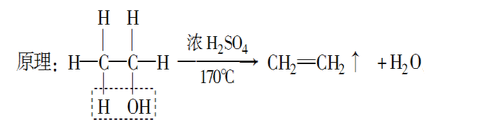
c.乙醇的取代反应
①乙醇和氢卤酸的反应
醇与氢卤酸(HCl、HBr、HI)发生反应时,碳氧键发生断裂,羟基被卤素原子取代,生成相应的卤代烃和水。例如:
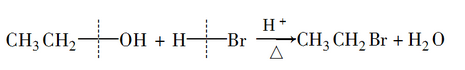
这也是实验室制备卤代烃的一种方法。
注意:通常用溴化钠和浓硫酸的混合物代替浓氢溴酸。此法是制备溴乙烷的一种方法:CH3CH2OH+NaBr+H2SO4→CH3CH2Br+NaHSO4+H2O。
②醇分子间脱水
在浓硫酸存在时,加热到一定温度,醇可以发生分子间的取代反应:一个醇分子中的烃氧基(RO—)取代另一个醇分子中的羟基(—OH),生成醚和水。例如:乙醇在浓硫酸作催化剂的情况下,加热到140 ℃时会生成乙醚和水。
![]()
③醇和羧酸的反应——酯化反应
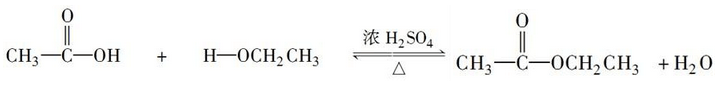
d.乙醇的氧化反应
①乙醇的燃烧
乙醇在空气里点燃后易燃烧,发出淡蓝色火焰,同时放出大量的热。乙醇完全燃烧生成二氧化碳和水:
![]()
②与强氧化剂的反应
C2H5OH可使酸性高锰酸钾溶液褪色。
③醇的催化氧化
实验:将完成螺旋状的粗铜丝在酒精灯上灼热后,铜丝变黑,插入乙醇中,铜丝表面变红,产生刺激性气味的气体。发生反应的化学方程式为:
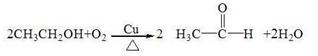
注意:
醇的催化氧化规律:
当α-C上有两个氢原子的醇被氧化时,则生成醛;
![]()
当α-C上有一个氢原子的醇被氧化时,生成酮;

当α-C上没有氢原子,不能被催化氧化。
3.酚
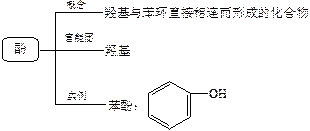
4.苯酚
(1)分子组成与结构
俗名:石炭酸
分子式:C6H6O
结构简式:![]()
结构特点:苯环上的一个氢原子被羟基取代。
(2)物理性质
①纯净的苯酚是无色、有特殊气味的晶体,若接触空气会因小部分被氧化而呈粉红色。
②常温下在水中溶解度不大,当温度高于65 ℃时,能与水混溶;易溶于有机溶剂,如乙醇、乙醚等。
③苯酚有毒,它的浓溶液对皮肤有强烈的腐蚀性,若不慎沾到皮肤上,应立即用酒精洗涤。
(3)化学性质
①苯酚的弱酸性
在水溶液中,苯酚易与氢氧化钠反应,苯酚有酸性。
a.苯酚与氢氧化钠溶液反应生成苯酚钠和水,化学方程式如下:
![]()
反应实质是酚羟基上的氢跟氢氧化钠的氢氧根结合成了水,故在这个反应中,苯酚显示了酸性,所以苯酚俗称石炭酸。
b.苯酚钠是一种盐,它易溶于水,易电离,是强电解质。苯酚钠在水溶液中电离的方程式为
![]()
向苯酚钠溶液中通入过量的二氧化碳气体,澄清溶液又变浑浊。
化学方程式为![]()
注意:
苯酚、碳酸、碳酸氢根的酸性强弱顺序为H2CO3>![]() >HCO3-。
>HCO3-。
②苯酚的取代反应
苯酚可与卤素单质、硝酸、硫酸等发生取代反应。
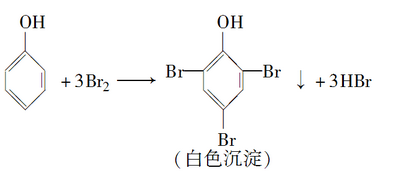
苯酚能与浓溴水反应生成不溶于水的白色沉淀(2,4,6-三溴苯酚),此反应很灵敏,常用于苯酚的定性检验和定量测定。
③苯酚的显色反应
向苯酚溶液中滴入几滴三氯化铁溶液,溶液显紫色,利用此反应可检验苯酚的存在。
(4)苯酚的用途
苯酚是重要的化工原料,广泛用于制造酚醛树脂、染料、医药、农药等,也可用作食品防腐剂和消毒剂。
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
相关文章
-
没有相关内容


 会员登录
会员登录