氯气的实验室制法要点归纳

实验室制取气体装置由发生装置、净化装置、收集装置以及尾气吸收装置组成。以Cl2的实验室制法为例(见下图):
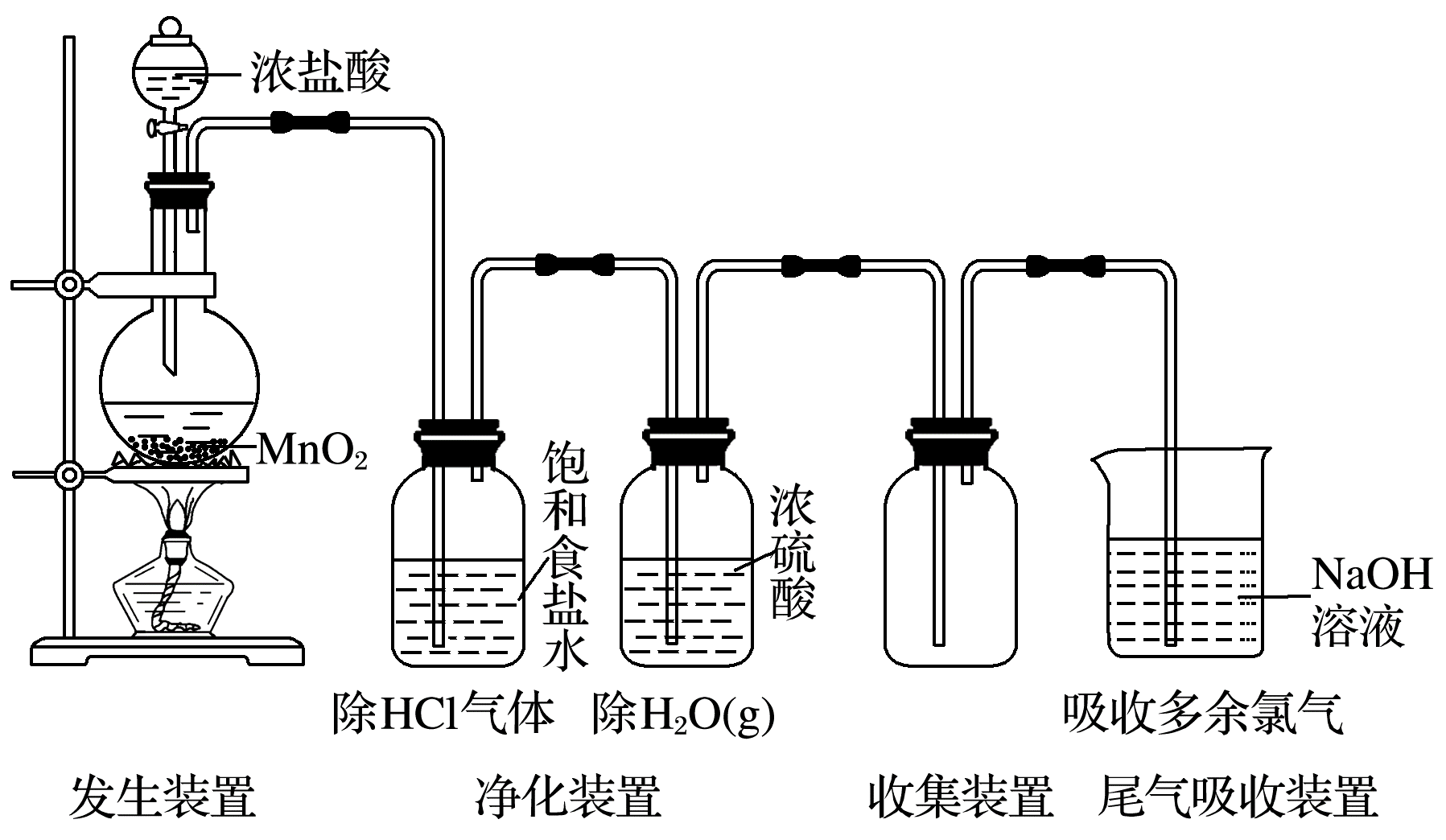
(1)反应原理:用强氧化剂(如KMnO4、K2Cr2O7、KClO3、MnO2等)氧化浓盐酸。
MnO2+4HCl(浓)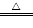 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
其他制取Cl2的原理:
①14HCl+K2Cr2O7===2KCl+2CrCl3+7H2O+3Cl2↑
②16HCl+2KMnO4===2KCl+2MnCl2+8H2O+5Cl2↑
③6HCl(浓)+KClO3===KCl+3H2O+3Cl2↑
④4HCl+Ca(ClO)2===CaCl2+2H2O+2Cl2↑
其中,①②④使用稀盐酸就可发生反应产生氯气。
(2)制备装置类型:固体+液体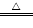 气体
气体
(3)净化方法:用饱和食盐水除去HCl,再用浓硫酸除去水蒸气。
(4)收集气体:向上排空气法或排饱和食盐水法。
(5)尾气吸收:用强碱溶液(如NaOH溶液)吸收,不用Ca(OH)2溶液吸收的原因是Ca(OH)2溶解度小,溶液浓度低,吸收不完全。
(6)验满方法:将湿润的淀粉KI试纸靠近盛Cl2的试剂瓶口,观察到试纸立即变蓝,则证明已集满;或将湿润的蓝色石蕊试纸靠近盛Cl2的试剂瓶口,观察到试纸先变红后褪色,则证明已集满。

Cl2的制法选项判断
(1)必须用浓盐酸,MnO2与稀盐酸不反应(√)
(2)为了减少制得的Cl2中HCl的含量,所以加热温度不宜过高,以减少HCl的挥发(√)
(3)MnO2与浓盐酸反应制Cl2的离子方程式:MnO2+4HCl Mn2++2Cl-+Cl2↑+2H2O(×)
Mn2++2Cl-+Cl2↑+2H2O(×)
(4)除去Cl2中少量HCl气体,可用饱和食盐水,也可用饱和碳酸氢钠溶液(×)
(5)检验氯气可用湿润的淀粉碘化钾试纸(√)
(6)氯气在饱和食盐水中的溶解度小于在纯水中的溶解度(√)
(7)实验室快速制取氯气可以采用高锰酸钾与浓盐酸的反应(√)
(8)用NaOH溶液吸收多余的Cl2时,为防止倒吸,导气管不能伸到液面以下(×)
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
相关文章
-
没有相关内容


 会员登录
会员登录