《物质的量的单位—摩尔》教学设计与反思
一.设计思想
“物质的量”是高一学生第一次接触到抽象的概念,它不仅承上启下,而且贯穿整个高中阶段的化学教学。“物质的量”属于“工具性”概念,是宏观与微观联系的桥梁,在化学计算中处于核心地位。“物质的量”的教学不仅是本章的重点,也是整个中学化学教学的重点。本节教学联系我国文化,以问题驱动,为化学计算埋下一颗“种子”。
二.教学设计方案
1.课题
所用教材:人民教育出版社出版,普通高中课程标准实验教科书化学必修1。
课题:第一章《2.化学计量在实验中的应用:一.物质的量的单位—摩尔》第一课时。
2.课程标准、教材及学情分析
“物质的量”及单位是初中学生进入高一后所学第一个概念,从概念的本身上来看,“物质的量”带“的”字的四字词组,似“物质的质量”又非“物质的质量”,拗口,难理解,容易混淆为“质量”或“数量”;从概念的发展上说,从我记忆中的“克当量”、“克当量”演变到今天的“物质的量”,教师对概念的理解上不太充分,对概念的历史形成及发展不太清楚,因而在把握“物质的量”的内涵时理解的不够准确,在课堂上往往只停留在对概念的理解上;从学生方面,初三化学的“量”局限在“化学方程式”,计量的依据也是建立在“1个”、“1份”与物质的质量关系的逻辑推理上,加上学生基础薄弱、理解能力不足及独立思考习惯没有养成,所以接受、理解及应用“拗口”的物质的量、建立严谨的宏观与微观上的定量思维时,显得无所事从。
3.教材目标
(1)知识与技能
①知道 “物质的量”是描述微观粒子集体的一个物理量,摩尔(mol)是其计量单位;知道1mol任何粒子的粒子数约为6.02×1023个;1mol任何粒子的粒子数叫做阿伏加德罗常数(符号为NA)。
②通过对具体物质组成的分析,理清构成物质的微观粒子(包括原子、分子、离子、原子团、电子、质子、中子)之间的数量关系,实现计量单位从个数到摩尔的转变。
(2)过程与方法:
①通过我国优秀文化中“计量”情景,感受用“摩尔”作为微观粒子计量单位的便利性,体会计量标准的设置对计量的重要性。
②通过摩尔、物质的量概念的学习及阿伏加德罗常数的应用,进一步感受物质是由微观粒子构成的,微观粒子很小,无法用常规的仪器和单位计量,建立初步的物质微粒观。
③通过学生阅读、讨论,类比、归纳,理解抽象的“物质的量”概念和它的单位,并初步理解建立“统计”思想在日常生活中的运用。
(3)情感态度和价值观:
通过联系优秀文化中“斗”和“升”对宏观物质的“计量”,对物质的量概念的透彻理解,知道自然科学与社会生活息息相关。培养学生严谨、务实、认真的学习态度。
4.教材难点、重点
教学重点:物质的量、摩尔;摩尔的基准,粒子的数目与物质的量间的关系。教学难点:物质的量概念;分子与原子等粒子间的逻辑关系。
5.教法和学法
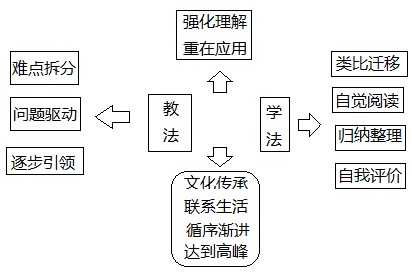
6. 教学思维导图

7.教学过程
环节1.回望我国优秀的传统文化
教师演讲:听听我小时候的花絮。]
汉书·卷二十一·律历志上:“十升为斗……斗者,聚升之量也。” 十升为一斗,十斗为一石。你是否知道,我国劳动人民用“升”、“斗”是用来“计量”什么的吗?
用来分小麦、小米、包谷等粮食,为什么不直接“数”个数呢?
学生实践活动展示:


教师展示:把小米倒在“升”中,演示“升”的计量公平。让学体验小米“小”,用“升”计量方便,感受“统计”的思想的应用。了解文化“计量”的发展。
[过度] 化学反应中的粒子是或原子、或分子、或离子,她们犹如粮食中的小麦、小米很小,无法数数,怎样能实现微粒的“数”与宏观中质量联系起来,是否像“升”和“斗”一样呢?
环节2.“升”与“斗”引出微粒子的计量单位,检查预习情况。
[阅读思考]
(1)“物质的量”是物理量?还是单位?如果是物理量,它的单位呢?
(2)“物质的量”概念中的“粒子”是指的是“宏观”还是“微观”?
(3)“物质的量”概念中的“一定数目”是指多少个粒子?
(4)“一定数目”是如何规定的?
(5)1mol任何粒子的粒子数是多少?用什么表示?通常取多少?
(6)阿伏加德罗常数的符号?单位?
(7)1mol氢,1molH,哪种表示规范科学?
[对话] 通过学生阅读与教师、同学们的交流,形成心心相映,让概念在阅读、独立思考、师生对话交流中生成。
[日记归纳]
物质的量(物理量) 单位(单位)
符号:n mol
定义: 物质的量—物理量
“一定数目”—1mol
或0.012kg 12C所含的碳原子数目
或阿伏加德罗常数;
“粒子”—微观粒子,如分子、原子、离子、电子等
“集体”—是粒子们的集合。
阿伏加德罗常数:1mol任何粒子的粒子数
符号:NA 单位:1mol-1
表示:1mol H2、1mol H、1mol H+
环节4.逻辑推理,生成概念
[师生对话]
(1).1mol O2含有6.02×1023个(NA取这个值)O2分子,0.2mol含有多少个O2分子?含有6.02×1022个O2分子的物质的量是多少mol?
(2)根据计算分析,你能否得出粒子的数目(N)、阿伏加德罗常数(NA)、粒子的物质的量(n)之间的关系
[日记] n=N/NA; N=n.NA
环节4.[知识迁移] 教师巡视,逐一辅导。
(1).1个H2O中含 个原子,1molH2O含 mol原子。
(2).1个H2O中含 个H原子、 个O原子, 1 mol H2O中含 mol H原子、 mol O原子。
环节5.[心心相映]
这节课你学了什么?你还哪些不太懂?
再一次阅读课本,体会归纳与整理;如果还有疑惑,老师欢迎你的到来。
8.教学反思
联系生活,让学生了解我国优秀文化。通过对物质的量概念进行拆分,有效地降低了学生的学习难度,学习过程循序渐进。通过类比“升”、“斗”等生活中的实例,使抽象概念形象直观,便于学生理解“拗口”的概念。以问题为驱动,通过层层铺垫、层层推进,布设小台阶,最终建立桥梁,保证了知识体系的完整性,可理解性,达到师生和谐,共享生成与发展成果。通过类比的方法建立概念,学生在学习知识的同时掌握学习方法,为之后气体摩尔体积、物质的量浓度概念的建立锦上添花。
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
- 上一篇:戚洁《气体摩尔体积》说课稿
- 下一篇:张银生《溶液的配制及分析》ppt课件
相关文章
-
没有相关内容


 会员登录
会员登录