盖斯定律
盖斯定律是计算反应热的重要依据,在生产和科研中有着重要的意义。利用盖斯定律,可以间接计算难以直接测定的反应热,如:
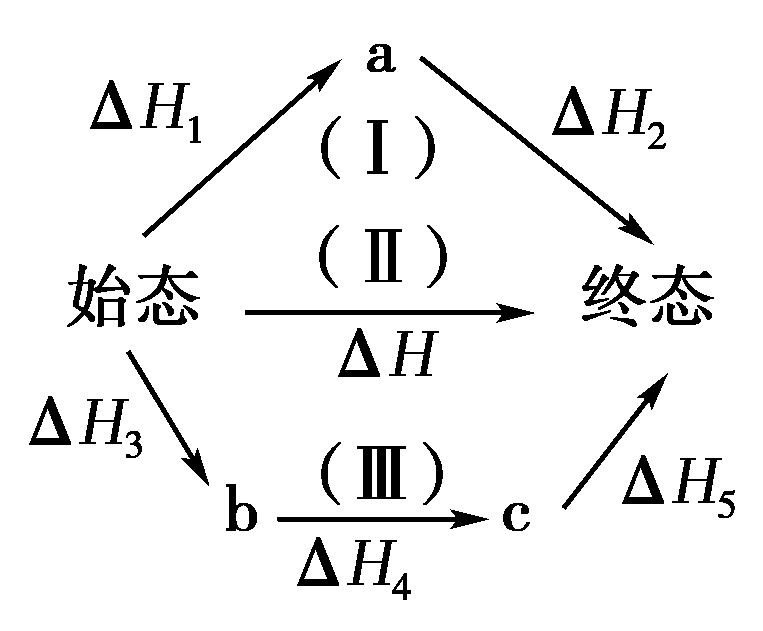
ΔH=ΔH1+ΔH2=ΔH3+ΔH4+ΔH5
1.盖斯定律的应用方法
(1)虚拟路径法
若反应物A变为生成物D,可以有两种途径:(a)由A直接变成D,反应热为ΔH;(b)由A经过B变成C,再由C变成D,每步的反应热分别为ΔH1、ΔH2、ΔH3。如图所示:
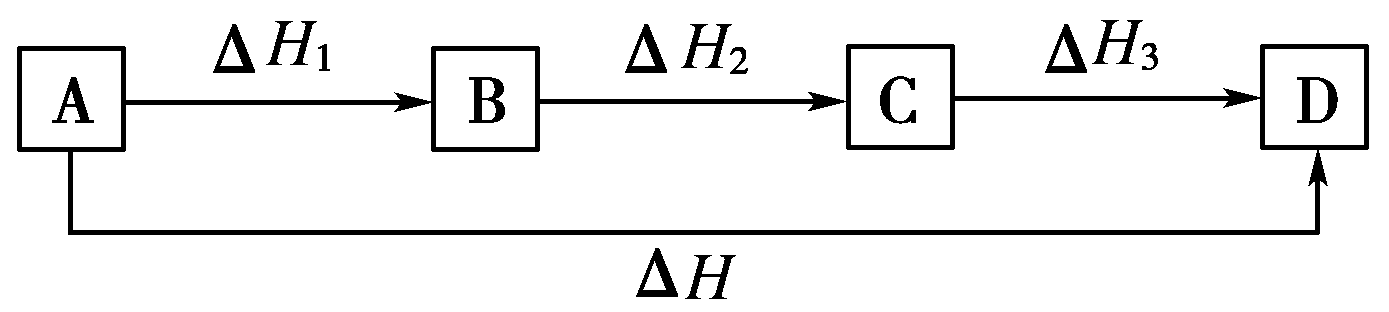
则有:ΔH=ΔH1+ΔH2+ΔH3
(2)加合法
即运用所给热化学方程式通过加减的方法得到所求热化学方程式。如,已知:a.2H2(g)+O2(g)=2H2O(g) ΔH1=-483.6 kJ/mol;b.H2O(g)=H2O(l) ΔH2=-44.0 kJ/mol。
要写出H2(g)+1/2O2(g)=H2O(l)的热化学方程式可虚拟如下过程:
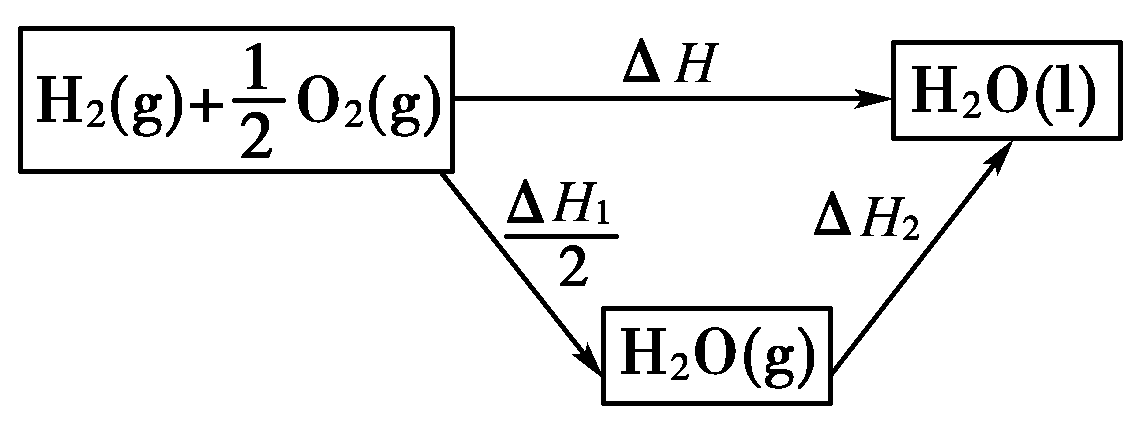
根据盖斯定律:
ΔH=ΔH1/2+ΔH2=-483.62kJ/mol+(-44.0 kJ/mol)=-285.8 kJ/mol。
所以:H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ/mol
也可由①×1/2+②得:
H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ/mol。
2.应用盖斯定律计算反应热时的注意事项
(1)热化学方程式同乘以或除以某一个数时,反应热数值也必须乘以或除以该数。
(2)热化学方程式相加减时,同种物质之间可相加、减,反应热也随之相加、减。
(3)热化学方程式中的反应热指反应按所给形式完全进行时的反应热。
(4)正、逆反应的反应热数值相等,符号相反。
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
相关文章
-
没有相关内容


 会员登录
会员登录