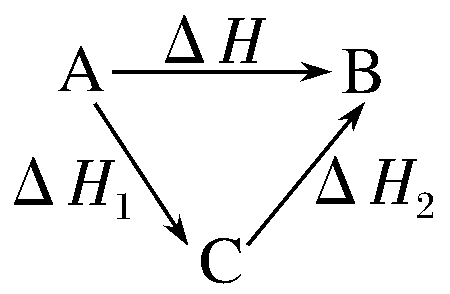盖斯定律及其重要应用知识精华
1.图示:盖斯定律的理解
热化学方程式 | 焓变之间的关系 |
aA===B ΔH1 A===1/aB ΔH2 | ΔH2=1/aΔH1或ΔH1=aΔH2 |
aA===B ΔH1 B===aA ΔH2 | ΔH1=-ΔH2 |
| ΔH=ΔH1+ΔH2 |
2.比较:反应热大小
(1)利用盖斯定律比较:
如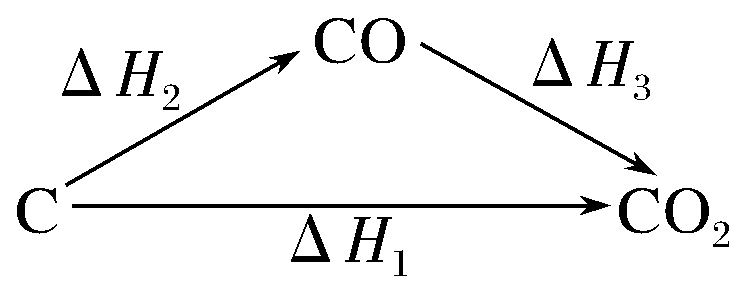 比较ΔH1与ΔH2的大小的方法。因ΔH1<0,ΔH2<0,ΔH3<0(均为放热反应),依据盖斯定律得ΔH1=ΔH2+ΔH3,即|ΔH1|>|ΔH2|,所以ΔH1<ΔH2。
比较ΔH1与ΔH2的大小的方法。因ΔH1<0,ΔH2<0,ΔH3<0(均为放热反应),依据盖斯定律得ΔH1=ΔH2+ΔH3,即|ΔH1|>|ΔH2|,所以ΔH1<ΔH2。
(2)同一反应的生成物状态不同时,如:
A(g)+B(g)===C(g) ΔH1,
A(g)+B(g)===C(l) ΔH2,
则ΔH1>ΔH2。
(3)同一反应物状态不同时,如:
A(s)+B(g)===C(g) ΔH1,
A(g)+B(g)===C(g) ΔH2,
则ΔH1>ΔH2。
3.规律:利用盖斯定律进行计算的一般步骤
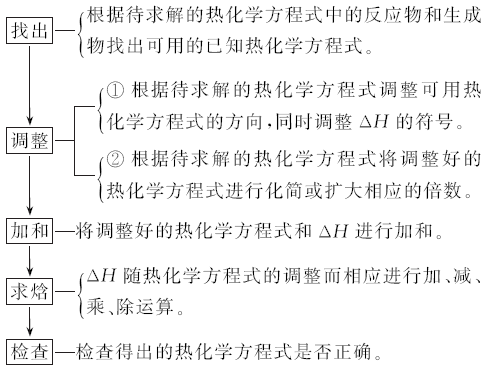
状元体会
体会①比较有关联的两个反应的反应热大小时,如:
C(s)+O2(g)===CO2(g) ΔH1①,
C(s)+1/2O2(g)===CO(g) ΔH2②。
可利用反应①(包括ΔH1)乘以某化学计量数减去反应②(包括ΔH2)乘以某化学计量数,即得出ΔH3=ΔH1×某化学计量数-ΔH2×某化学计量数,根据ΔH3大于0或小于0进行比较。
体会②叠加法书写热化学方程式
如:向足量H2SO4溶液中加入100 mL 0.4 mol·L-1Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入100 mL 0.4 mol·L-1盐酸时,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为:Ba2+(aq)+SO42-(aq)===BaSO4(s) ΔH=-18 kJ/ mol。
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
相关文章
-
没有相关内容


 会员登录
会员登录