反应热与焓变知识精华
1.知识整合:
三个角度理解产生化学反应热效应的原因

(1)从宏观角度分析:
ΔH=H1生成物的总能量-H2反应物的总能量
(2)从微观角度分析:
ΔH=E1反应物的键能总和-E2生成物的键能总和
(3)从活化能角度分析:
ΔH=E1正反应活化能-E2逆反应活化能
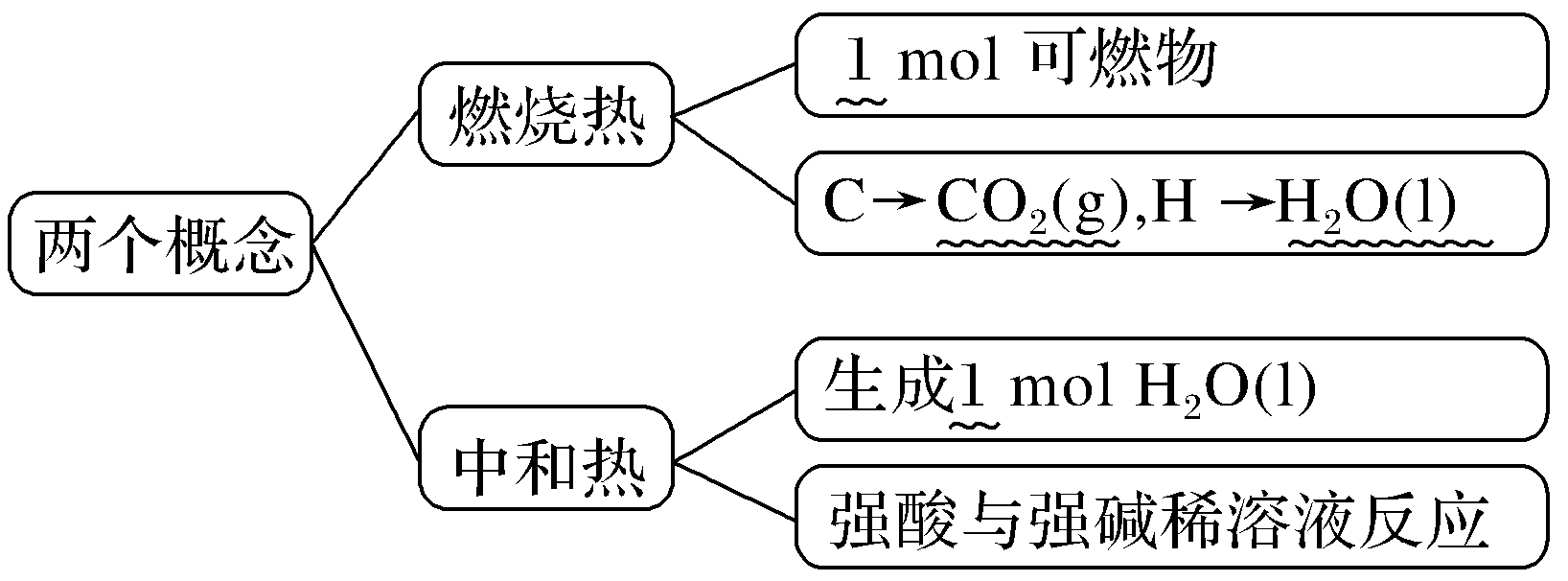
2.燃烧热与中和热
状元体会
对于反应热和焓变的理解,应抓住概念的本质,一般情况下,我们研究的多为理想状态,即反应热等同于焓变,根据常见题目设置,常见的易错易误点有以下几点:
①误认为放热反应不需加热,吸热反应必须加热。
②混淆能量(物质的焓)与键能的关系,误认为键能越大,能量越高,其实是键能越大,物质越稳定,能量越低。
③误认为反应条件不同时,ΔH也不同,其实并非如此。如同温同压下,H2(g)和Cl2(g)的总能量与HCl(g)的总能量的差值不受光照和点燃条件的影响,故该反应的ΔH相同。
④误认为可逆反应的反应热与物质转化率有关,其实不是这样。如2SO2(g)+O2(g)  2SO3(g) ΔH=-197 kJ/mol,指2 mol SO2(g)和1 mol O2(g)完全反应生成2 mol SO3(g)时放出的热量为197 kJ。
2SO3(g) ΔH=-197 kJ/mol,指2 mol SO2(g)和1 mol O2(g)完全反应生成2 mol SO3(g)时放出的热量为197 kJ。
⑤燃烧热是指101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时放出的热量,并不是1 mol可燃物燃烧时放出的热量就是燃烧热。
⑥中和热不是指1 mol酸与1 mol碱中和时的热效应,而是指“生成1 mol H2O(l)”的热效应。
| 很有帮助 | 一点没用 | 马虎还行 | 点错路过 | 继续努力 |
- 上一篇:三维设计高考复习课件试题学案资料包第六…
- 下一篇:热化学方程式的书写与判断知识精华
相关文章
-
没有相关内容


 会员登录
会员登录